Spiriva Respimat
Bula do Medicamento - Farmacologia do Remédio
Spiriva Respimat, para o que é indicado e para o que serve?
Spiriva Respimat é indicado para o tratamento de manutenção de pacientes com Doença Pulmonar Obstrutiva Crônica (DPOC) que, caracterizada por tosse , catarro e falta de ar, ocorre principalmente em decorrência da inalação da fumaça de cigarro, incluindo também bronquite crônica e enfisema pulmonar (irritação respiratória crônica), associada à dispneia (falta de ar), melhora da qualidade de vida e redução dos episódios de exacerbação (crises de agravamento) da doença.
Spiriva Respimat é indicado também como tratamento adicional de manutenção para melhora dos sintomas da asma ( cansaço , falta de ar, chiado no peito e tosse), qualidade de vida e redução das exacerbações em pacientes a partir de 6 anos de idade com asma moderada tratados com pelo menos corticosteroides inalatórios ou asma grave tratados com corticosteroides inalatórios e agonistas beta-adrenérgicos de longa duração que permaneçam sintomáticos.
Como o Spiriva Respimat funciona?
Spiriva Respimat atua dilatando os brônquios (broncodilatador), facilitando assim a passagem de ar pelos pulmões. O efeito se inicia em até 30 minutos após a inalação e dura 24 horas.
Quais as contraindicações do Spiriva Respimat?
Você não deve usar Spiriva Respimat se tiver alergia à atropina ou seus derivados (como ipratrópio ou oxitrópio) ou a qualquer um dos componentes da fórmula.
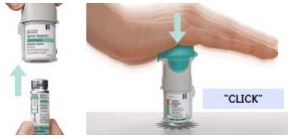
Como usar o Spiriva Respimat?
1 dose liberada (puff) = conteúdo expelido após apertar 1 vez o botão do inalador Respimat.
Instruções de uso
Leia estas instruções antes de começar a usar Spiriva Respimat. Crianças devem usar Spiriva Respimat com a assistência de um adulto.
Você precisará usar esse inalador apenas uma vez ao dia.
Cada vez que você utilizá-lo inale duas doses liberadas (2 puffs) consecutivas.

- Se Spiriva Respimat não for utilizado por mais de 7 dias, liberar uma dose liberada (1 puff) em direção ao chão;
- Se Spiriva Respimat não for utilizado por mais de 21 dias, repita os passos 4-6 em "Preparar para uso pela primeira vez" até que uma nuvem seja visível. Em seguida, repita os passos 4 a 6 mais 3 vezes.
Como cuidar do seu Spiriva Respimat
Limpe o bocal, inclusive a parte metálica dentro dele, apenas com um pano úmido ou um lenço, pelo menos uma vez por semana.
Uma pequena descoloração do bocal não afeta o funcionamento do seu inalador Spiriva Respimat.
Quando providenciar um novo Spiriva Respimat
- Seu inalador Spiriva Respimat contém 60 doses liberadas (60 puffs) se usado conforme indicado, ou seja, duas doses liberadas (2 puffs) uma vez ao dia;
- O indicador mostra aproximadamente quanto de medicação resta no frasco;
- Quando o indicador entrar na área vermelha da escala você precisa de uma nova prescrição médica; existe medicação para aproximadamente mais 7 dias, ou seja, 14 doses liberadas (14 puffs);
- Uma vez que o indicador de doses tenha atingido o final da escala vermelha, seu Spiriva Respimat se travará automaticamente e não haverá mais doses a serem liberadas. Neste momento, a base não poderá mais ser girada.;
- Três meses depois do primeiro uso, Spiriva Respimat deverá ser descartado mesmo se todo o medicamento não tiver sido utilizado.
Preparar para uso pela primeira vez
Remover a base transparente
- Mantenha a tampa fechada;
- Pressione o dispositivo de segurança e ao mesmo tempo retire a base transparente com sua outra mão;
Inserir o frasco
- Insira o lado estreito do frasco no inalador;
- Coloque o inalador sobre uma superfície firme (por exemplo, uma mesa) e pressione para baixo com firmeza até que o frasco se encaixe.
Retornar a base transparente
- Coloque a base transparente de volta ao seu lugar até ouvir um clique.
Virar
- Mantenha a tampa fechada;
- Vire a base transparente na direção das setas do rótulo até ouvir um clique (meia volta).
Abrir
- Abra a tampa até que fique travada completamente na posição aberta.
Pressionar
- Aponte o inalador em direção ao chão;
- Pressione o botão de aplicação;
- Feche a tampa;
- Repita os passos 4 a 6 até que seja visível uma nuvem;
- Após visualizar a nuvem, repita os passos 4 a 6 mais três vezes.
Uso diário
Vire
- Mantenha a tampa fechada;
- Vire a base transparente na direção das setas do rótulo até ouvir um clique (meia volta).
Abra
- Abra a tampa até que fique travada completamente na posição aberta.
Pressione:
- Expire (solte o ar) lenta e totalmente;
- Coloque os lábios em torno do bocal, sem cobrir as entradas de ar;
- Enquanto inspira (enche o peito de ar) lenta e profundamente pela boca, pressione o botão de aplicação e continue inspirando;
- Prenda a respiração por 10 segundos ou o quanto puder com conforto e, em seguida, volte a respirar normalmente;
- Repita os passos vire, abra e pressione para um total de 2 puffs.
Respostas às perguntas mais frequentes
É difícil inserir o frasco até o final
Você virou a base transparente acidentalmente antes de inserir o frasco?
- Abra a tampa, pressione o botão de aplicação, então insira o frasco.
Você inseriu o frasco pelo lado mais largo?
- Insira o frasco pelo lado mais estreito.
Eu não consigo pressionar o botão de aplicação
Você virou a base transparente?
- Se não, vire a base transparente em movimento contínuo até ouvir um clique (meia volta).
O indicador de dose de Spiriva Respimat está sinalizando 0 (zero)?
- O inalador Spiriva Respimat é bloqueado após 60 doses liberadas (puffs). Neste caso, prepare e use um novo inalador Spiriva Respimat.
Não consigo virar a base transparente
Você já virou a base transparente?
- Se a base transparente já foi virada, siga os passos “Abra” e “Pressione” conforme instruções contidas em “Uso diário” para administrar seu medicamento.
O indicador de dose de Spiriva Respimat está sinalizando 0 (zero)?
- O inalador Spiriva Respimat é bloqueado após 60 doses liberadas (puffs). Neste caso, prepare e use um novo inalador Spiriva Respimat.
O indicador de dose do Spiriva Respimat atinge o 0 (zero) muito rápido
Você usou Spiriva Respimat conforme indicado, ou seja, 2 doses liberadas (puffs), uma vez ao dia?
- Spiriva Respimat durará 30 dias se usado corretamente, ou seja, 2 doses liberadas (puffs), uma vez ao dia.
Você virou a base transparente antes de inserir o frasco?
- O indicador de dose conta cada giro da base transparente, independentemente se um frasco foi inserido ou não.
Você disparou Spiriva Respimat mais vezes que o necessário, para verificar se está funcionando?
- Uma vez que você tenha preparado Spiriva Respimat, nenhum novo teste é necessário, se usado diariamente.
Você inseriu o frasco num Spiriva Respimat usado?
- Sempre insira um novo frasco num Spiriva Respimat novo.
Meu Spiriva Respimat dispara automaticamente
A tampa estava aberta quando você virou a base transparente?
- Feche a tampa, então vire a base transparente.
Você pressionou o botão de aplicação quando virou a base transparente?
- Feche a tampa para o botão de aplicação ficar coberto, então vire a base transparente.
Você parou antes do “clique”, quando virava a base transparente?
- Vire a base transparente num movimento contínuo até ouvir um “clique” (meia volta).
Meu Spiriva Respimat não dispara
Você inseriu o frasco?
- Se não, insira o frasco.
Você repetiu os passos vire, abra, pressione menos de 3 vezes após inserir o frasco?
- Repita os passos vire, abra, pressione 3 vezes após inserir o frasco, conforme demonstrado nos passos 4 a 6 na seção “Preparar para uso pela primeira vez”.
O indicador de dose no Spiriva Respimat está indicando 0 (zero)?
- Se o indicador de dose indicar 0 (zero), você utilizou todo o medicamento e o inalador foi travado.
- Uma vez que o Spiriva Respimat é montado, não remova a base transparente ou o frasco. Sempre insira um novo frasco num Spiriva Respimat novo.
Doença Pulmonar Obstrutiva Crônica (DPOC)
População adulta
- A dose terapêutica diária recomendada de Spiriva Respimat é a inalação de 5 mcg, ou seja, 2 doses liberadas (2 puffs) consecutivas uma vez ao dia pelo inalador Respimat, no mesmo horário do dia.
*DPOC não ocorre normalmente em crianças.
Asma
População adulta e pediátrica a partir de 6 anos de idade
- A dose terapêutica diária recomendada de Spiriva Respimat é a inalação de 5 mcg, ou seja, 2 doses liberadas (2 puffs) consecutivas, uma vez ao dia pelo inalador Respimat, no mesmo horário do dia. No tratamento da asma, os benefícios aparecem após diversas doses de Spiriva Respimat.
*A eficácia e segurança de Spiriva Respimat em crianças com idade inferior a 6 anos de idade com asma não foram estabelecidas.
População especial
Pacientes idosos ou com alterações da função do fígado podem utilizar Spiriva Respimat na dose recomendada.
Pacientes com comprometimento moderado a grave da função dos rins podem utilizar Spiriva Respimat na dose recomendada, mas devem ser acompanhados de perto.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que eu devo fazer quando esquecer de usar o Spiriva Respimat?
Continue inalando as próximas doses regularmente no horário habitual. Não duplique a dose na próxima inalação.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico ou cirurgião dentista.
Quais cuidados devo ter ao usar o Spiriva Respimat?
Spiriva Respimat é um broncodilatador para tratamento crônico, com dose única diária, e não se destina ao tratamento inicial de casos agudos de estreitamento dos brônquios (episódios de falta de ar) ou para o alívio de sintomas agudos. No caso de um ataque agudo, um beta-2-agonista de ação rápida (como fenoterol ou salbutamol ) deve ser usado sob orientação médica.
Caso não observe melhora do ataque agudo ou em caso de dúvidas, procure um médico ou serviço de emergência imediatamente.
Spiriva Respimat não deve ser usado como primeira linha para o tratamento da asma.
Pacientes asmáticos devem ser orientados a continuar com o tratamento usual, por exemplo, corticosteroides inalatórios sem necessidade de alterá-lo após a introdução de Spiriva Respimat, mesmo após os sintomas da asma terem melhorado.
Após administração de Spiriva Respimat, podem ocorrer reações alérgicas imediatas.
Spiriva Respimat deve ser usado com cuidado se você tiver glaucoma de ângulo fechado (aumento da pressão dentro do olho), aumento da próstata ou obstrução do colo da bexiga. Caso você apresente uma destas condições, avise o seu médico.
Pode ocorrer broncoespasmo (estreitamento dos brônquios) induzido pela inalação.
Spiriva Respimat é eliminado predominantemente pelos rins. Se você tiver alguma doença que afete a função dos rins, é necessário o acompanhamento cuidadoso do médico. Portanto, informe seu médico se tiver algum problema nos rins.
Evite contato do medicamento com os olhos. Dor nos olhos, visão embaçada, visão de halos ou imagens coloridas com olhos avermelhados podem ser sinais de glaucoma.
Nestes casos, procure um oftalmologista imediatamente.
Colírios para contrair a pupila não são considerados um tratamento eficaz.
A dose recomendada de Spiriva Respimat é 2 doses liberadas (2 puffs) consecutivas, uma vez ao dia. Você não deve usar Spiriva Respimat mais de uma vez ao dia. O frasco de Spiriva só deve ser utilizado com o inalador Respimat que acompanha o produto.
A ocorrência de tontura ou visão embaçada pode prejudicar a habilidade de dirigir e operar máquinas.
A cada dose liberada (puff), este produto contém 0,0011 mg de cloreto de benzalcônio. O cloreto de benzalcônio pode causar chiado e a respiração pode se tornar difícil, sendo que o risco destes eventos adversos ocorrerem é maior nos pacientes com asma.
Fertilidade, gravidez e amamentação
O uso de Spiriva Respimat não é recomendado durante a gravidez e amamentação. Existem dados limitados do uso deste medicamento durante a gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Quais as reações adversas e os efeitos colaterais do Spiriva Respimat?
DPOC
- Reação comum: boca seca (geralmente leve);
- Reações incomuns: tontura, tosse, faringite , disfonia (rouquidão), constipação , candidíase orofaríngea (sapinho), erupção cutânea ( rash ), prurido (coceira), retenção urinária (geralmente em homens com fatores de predisposição), disúria (dificuldade e dor para urinar);
- Reações raras: insônia , glaucoma, aumento da pressão intraocular, visão borrada, alterações nos batimentos do coração (como fibrilação atrial, taquicardia supraventricular, taquicardia), palpitações, epistaxe (sangramento nasal), broncoespasmo (estreitamento dos brônquios), laringite (inflamação da laringe), disfagia (dificuldade para engolir), doença do refluxo gastroesofágico (doença do refluxo), gengivite (inflamação da gengiva), glossite (inflamação da língua), edema angioneurótico (alergia com inchaço da língua, lábios e garganta), urticária , infecção e úlcera cutânea (na pele), pele seca , infecção do trato urinário;
- Reações com frequência desconhecidas: desidratação , sinusite , estomatite , obstrução intestinal inclusive íleo paralítico (obstrução do intestino interrompendo a passagem das fezes), hipersensibilidade (inclusive reações imediatas), edema articular.
Asma
- Reações incomuns: tontura, insônia, palpitações, tosse, faringite, disfonia (rouquidão), broncoespasmo (estreitamento dos brônquios), boca seca, candidíase orofaríngea (sapinho), erupção cutânea ( rash );
- Reações raras: epistaxe (sangramento nasal), constipação, gengivite (inflamação da gengiva), estomatite, prurido (coceira), edema angioneurótico (alergia com inchaço da língua, lábios e garganta), urticária, hipersensibilidade (inclusive reações imediatas), infecção do trato urinário;
- Reações com frequência desconhecida: desidratação, glaucoma, aumento da pressão intraocular, visão borrada, alterações nos batimentos do coração (como fibrilação atrial, taquicardia supraventricular, taquicardia), laringite (inflamação da laringe), sinusite, disfagia (dificuldade para engolir), refluxo gastroesofágico (doença do refluxo), glossite (inflamação da língua), obstrução intestinal inclusive íleo paralítico (obstrução do intestino interrompendo a passagem das fezes), infecção e úlcera cutânea (na pele), pele seca, inchaço das articulações, retenção urinária (geralmente em homens com fatores de predisposição), disúria (dificuldade e dor para urinar).
A frequência, tipo e gravidade das reações adversas na população pediátrica são similares às de adultos.
Atenção: este produto é um medicamento que possui uma nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
Apresentações do Spiriva Respimat
Solução para inalação oral 2,5 mcg/puff
Frasco de 4 mL (60 doses liberadas (60 puffs) que equivalem a um mês de tratamento) acompanhado do inalador Respimat.
Inalação oral.
Uso adulto e pediátrico a partir de 6 anos.
Qual a composição do Spiriva Respimat?
Cada dose (puff) libera:
2,5 mcg de tiotrópio, correspondentes a 3,124 mcg de brometo de tiotrópio monoidratado.
Excipientes: cloreto de benzalcônio, edetato dissódico, ácido clorídrico, água purificada.
Dose terapêutica diária = 5 mcg, ou seja, 2 doses liberadas (2 puffs consecutivos).
Superdose: o que acontece se tomar uma dose do Spiriva Respimat maior do que a recomendada?
Altas doses de Spiriva Respimat podem acelerar os batimentos cardíacos, alterar a movimentação do estômago e intestinos e reter urina. Não foram observados eventos adversos relevantes, além de boca, garganta e nariz secos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Spiriva Respimat com outros remédios?
A administração crônica de outros medicamentos anticolinérgicos (como atropina, biperideno , ipratrópio, glicopirrônio, umeclidínio) com Spiriva Respimat não é recomendada.
Corticosteroides inalatórios (como budesonida , fluticasona, mometasona) e suas combinações com LABA (por exemplo, formoterol, salmeterol ), as quais são medicações concomitantes e comumente usadas por pacientes com DPOC, não demonstraram alterar a exposição ao tiotrópio.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem conhecimento do seu médico. Pode ser perigoso para sua saúde.
Qual a ação da substância do Spiriva Respimat (Brometo de Tiotrópio)?
Resultados de Eficácia
DPOC
O programa de fase III para DPOC incluiu dois estudos de 1 ano, dois estudos de 12 semanas e dois estudos de 4 semanas randomizados, duplo-cegos, em 2.901 pacientes com DPOC (1.038 deles recebendo 5 mcg de Brometo de Tiotrópio). O programa de 1 ano consistiu de dois estudos controlados com placebo. Os dois estudos de 12 semanas foram ambos ativos (ipratrópio) e controlados com placebo. Todos os seis estudos incluíram mensurações da função pulmonar. Além disto, os dois estudos de 1 ano incluíram medidas de desfechos de saúde: medidas da intensidade da dispneia, qualidade de vida relacionada à saúde e efeito nas exacerbações.
Estudos controlados por placebo
Função pulmonar
Brometo de Tiotrópio, administrado uma vez ao dia, promoveu melhora significativa da função pulmonar (volume expiratório forçado no primeiro segundo (VEF1) e capacidade vital forçada (CVF)) dentro de 30 minutos após a primeira administração, comparativamente ao placebo. A melhora da função pulmonar foi mantida por 24 horas no estado de equilíbrio.
O estado de equilíbrio farmacodinâmico foi atingido em uma semana. Brometo de Tiotrópio melhorou significativamente as taxas matutinas e vespertinas de pico de fluxo expiratório (PEFR) conforme a avaliação dos registros diários do paciente. O uso de Brometo de Tiotrópio resultou em redução do uso de broncodilatador de resgate em comparação com o placebo.
Os efeitos broncodilatadores de Brometo de Tiotrópio foram mantidos durante o período de 48 semanas da administração sem qualquer evidência de desenvolvimento de tolerância.
Figura 1: VEF1 médio (litros) em cada momento (antes e após a administração da medicação do estudo) respectivamente nos dias 1 e 337 (dados combinados de dois estudos de 1 ano com grupos paralelos)*

* Média ajustada por centro, condição de tabagismo e efeito basal. Um total de, respectivamente, 545 e 434 pacientes nos grupos SPIRIVA e placebo, concluíram as avaliações no dia 337. Os dados dos demais pacientes foram incluídos considerando-se a última observação ou a menos favorável obtida no estudo.
Figura 2: VEF1 médio (litros) em cada momento (antes e após a administração da medicação do estudo) nos Dia 1 e 85, respectivamente (dados combinados de dois estudos de 12 semanas, em grupos paralelos)

Respectivamente um total de 155, 142 e 152 pacientes nos grupos SPIRIVA, ATROVENT MDI (ipratrópioaerossol) e placebo, concluíram os exames do dia 85. Os dados para os demais pacientes foram incluídos considerando-se a última observação ou a menos favorável obtida.
Figura 3: VEF1 médio (litros) em cada momento (antes e após a administração da medicação do estudo) no Dia 29 (dados combinados de dois estudos cruzados de 4 semanas, 205.249 e 205.250) *

* Médias ajustadas por centro, paciente (em cada centro), período e efeito basal. Os dados para os pacientes que descontinuaram previamente o estudo foram incluídos considerando-se a última observação ou a menos favorável. Os pacientes que concluíram os estudos receberam os três tratamentos.
Uma análise combinada de dois estudos randomizados, controlados com placebo, cruzados, demonstrou que a resposta broncodilatadora de Brometo de Tiotrópio (5 mcg) foi numericamente superior à obtida com a inalação de SPIRIVA (18 mcg) em pó após 4 semanas de tratamento.
Dispneia, Qualidade de Vida Relacionada à Saúde, exacerbações de DPOC em estudos de longo prazo de 1 ano
- Brometo de Tiotrópio melhorou de forma significativa a dispneia (avaliado utilizando o Índice Transicional de Dispneia). A melhora foi mantida durante todo o período de tratamento.
- A avaliação dos pacientes sobre a Qualidade de Vida (mensurada utilizando o Questionário Respiratório St. George - QRSG) mostrou que Brometo de Tiotrópio teve efeito positivo nos impactos psicossociais da DPOC, nas atividades afetadas pela DPOC, e no desconforto devido aos sintomas de DPOC. A melhora no índice médio global entre Brometo de Tiotrópio comparativamente ao placebo ao final dos dois estudos de 1 ano foi estatisticamente significativa e mantida durante todo o período de tratamento.
Exacerbações de DPOC
Em 3 estudos clínicos de um ano, randomizados, duplo-cegos, controlados por placebo, o tratamento com Brometo de Tiotrópio resultou em uma significante redução de risco para exacerbação de DPOC, em comparação com placebo.
Exacerbações de DPOC foram definidas como “um complexo de pelo menos 2 eventos respiratórios/sintomas com uma duração de 3 dias ou mais, requerendo uma mudança no tratamento (prescrição de antibióticos e/ou corticosteroides sistêmicos e/ou uma mudança significativa da medicação respiratória prescrita)”.
O tratamento com Brometo de Tiotrópio resultou num risco reduzido de hospitalização devido à exacerbação de DPOC (resultado significativo nos estudos robustos com poder estatístico apropriado para avaliar exacerbações) (significante no estudo clínico apropriado da primeira exacerbação e das subsequentes)). A análise agrupada dos dois estudos de Fase III e avaliação separada de um estudo clínico de exacerbação adicional é demonstrada na Tabela 1. Todos os medicamentos respiratórios, exceto anticolinérgicos e beta-agonistas de ação longa foram autorizados como tratamento concomitante, ou seja, beta-agonistas de ação rápida, corticoides inalados e xantinas. Beta-agonistas de ação longa foram permitidos, em adição ao estudo clínico de exacerbação.
Tabela 1: Análise estatística de exacerbações de DPOC e pacientes hospitalizados por exacerbações de DPOC em pacientes portadores de DPOC moderada a grave
| Estudo (N Spiriva , N placebo ) | Desfecho | Brometo de Tiotrópio | Placebo | % de Redução de risco (IC 95%) a | Valor de p |
| Estudos de 1 ano - fase III, análise agrupada d | Dias até a primeira exacerbação de DPOC | 160 a | 86 a | 29 (16 to 40) b | <0.0001 b |
| Taxa média de incidência de exacerbação por paciente/ano | 0.78 c | 1.00 c | 22 (8 to 33) c | 0.002 c | |
| Tempo para a primeira exacerbação de DPOC com hospitalização | NA e | NA e | 25 (-16 to 51) b | 0.20 b | |
| Taxa média de incidência de exacerbação com hospitalização por paciente/ano | 0.09 c | 0.11 c | 20 (-4 to 38) c | 0.096 c | |
| Estudo de exacerbação de 1 ano – fase IIIb | Dias até a primeira exacerbação de DPOC | 169 a | 119 a | 31 (23 to 37) b | <0.0001 b |
| Taxa média de incidência de exacerbação por paciente/ano | 0.69 c | 0.87 c | 21 (13 to 28) c | <0.0001 c | |
| Tempo para a primeira exacerbação de DPOC com hospitalização | NA e | NA e | 27 (10 to 41) b | 0.003 b | |
| Taxa média de incidência de exacerbação com hospitalização por paciente/ano | 0.12 c | 0.15 c | 19 (7 to 30) c | 0.004 c |
a Tempo até o primeiro evento: dias em tratamento quando 25% de pacientes tiveram pelo menos uma exacerbação de DPOC / exacerbação de DPOC com hospitalização.
No estudo A, 25% dos pacientes com placebo apresentaram a primeira exacerbação no dia 112, enquanto para Brometo de Tiotrópio 25% apresentaram a primeira exacerbação somente no dia 173 (p=0.09); no estudo B, 25% os pacientes com placebo apresentaram a primeira exacerbação no dia 74, enquanto para Brometo de Tiotrópio 25% apresentaram a primeira exacerbação apenas no dia 149 (p<0.0001).
b Razões de risco foram estimadas de um modelo de risco proporcional de Cox. A porcentagem de redução de risco é 100 (1 – razão de risco).
c Regressão de Poisson. Redução de risco é 100 (1 – razão de risco)
d A análise agrupada foi especificada quando os estudos foram desenhados. Os desfechos de exacerbação foram significantemente aperfeiçoados em análises individuais dos dois estudos de um ano.
e Menos de 25% de pacientes tiveram uma exacerbação de DPOC levando a hospitalização.
Estudo de longo prazo controlado com ativo Brometo de Tiotrópio
Um estudo de longo prazo, em grande escala, randomizado, duplo-cego, ativo controlado, com um período de tratamento de até 3 anos foi realizado para comparar a eficácia e a segurança de Brometo de Tiotrópio e SPIRIVA HandiHaler (5.711 pacientes receberam Brometo de Tiotrópio na dose terapêutica de 5 microgramas/dia); 5.694 pacientes receberam SPIRIVA HandiHaler). Os desfechos primários foram: tempo até a primeira exacerbação de DPOC, o tempo para a mortalidade por todas as causas e, em um sub-estudo (906 pacientes), curva (variação) do volume expiratório forçado - FEV1 (pré-dose).
O tempo até a primeira exacerbação de DPOC foi semelhante durante o estudo com Brometo de Tiotrópio e SPIRIVA HandiHaler (razão de risco (Brometo de Tiotrópio / SPIRIVA HandiHaler) 0,98 com um IC 95% de 0,93 a 1,03).
O número médio de dias para a primeira exacerbação de DPOC foi de 756 dias para Brometo de Tiotrópio e 719 dias para SPIRIVA HandiHaler.
O efeito broncodilatador do Brometo de Tiotrópio foi sustentado por 120 semanas e foi semelhante ao SPIRIVA HandiHaler. A diferença média de volume expiratório forçado - FEV1 para Brometo de Tiotrópio versus SPIRIVA HandiHaler foi -0,010 L (IC 95% -0,038 a 0,018 mL).
Mortalidade por todas as causas foi semelhante durante o estudo com Brometo de Tiotrópio e SPIRIVA HandiHaler (razão de risco (Brometo de Tiotrópio / SPIRIVA HandiHaler) 0,96 com um IC 95% de 0,84 a 1,09).
Asma
Pacientes adultos
O programa de fase III para asma persistente incluiu dois estudos de 1 ano, dois estudos de 6 meses e um estudo de 12 semanas randomizados, duplo-cegos, controlados por placebo em um total de 3.476 pacientes com asma (1.128 deles recebendo Brometo de Tiotrópio) com histórico de tratamento com pelo menos, corticoide inalatório (CIs) ou CIs/ Beta 2 agonista de longa duração (LABA). Os dois estudos de 6 meses foram ambos controlados com ativo ( salmeterol ). Os cinco estudos incluíram mensurações da função pulmonar, avaliação dos sintomas incluindo exacerbações e qualidade de vida relacionada à saúde.
Nos dois estudos de 1 ano Primo-TinA-asma em pacientes sintomáticos na manutenção do tratamento com pelo menos, altas doses de CIs e LABA, Brometo de Tiotrópio, usado em adição ao tratamento prévio, mostrou melhora significativa da função pulmonar comparativamente ao placebo.
- Na semana 24, a melhoria na média do pico e vale de VEF1 foi de 0,110 litros (IC 95%: 0,063 a 0,158 litros, p<0,0001) e 0,093 litros (IC 95%: 0,050 a 0,137 litros, p<0,0001), respectivamente.
- A melhora na função pulmonar comparada com o placebo foi mantida por 24 horas (Figura 4).
Figura 4: perfil de FEV1 durante 24 horas em um subconjunto de pacientes do estudo Primo-TinA-asma na semana 24

- Na semana 24, observa-se que Brometo de Tiotrópio melhorou significativamente as taxas matutinas e vespertinas de pico de fluxo expiratório (PFE, média matutina melhorada: 23 L/min; IC 95%: 16 a 29 L/min; p<0,0001; média vespertina melhorada: 26 L/min; IC 95%: 20 a 33 L/min; p<0,0001).
- Os efeitos broncodilatadores de Brometo de Tiotrópio foram mantidos durante o período de 1 ano de administração sem qualquer evidência de taquifilaxia ou tolerância.
Figura 5: resposta da FEV1 durante 48 semanas nos estudos Primo-TinA-asma

- Brometo de Tiotrópio reduziu significativamente o risco de exacerbações da asma grave (vide Tabela 2 e Figura 6).
Tabela 2: Exacerbações em pacientes sintomáticos em tratamento com CIs e LABA (estudos Primo-TinAasma)
| Estudo | Objetivo | Brometo de Tiotrópio Adicional ao tratamento com pelo menos CIs/LABA (N=453) | Placebo Adicional ao tratamento com pelo menos CIs/LABA (N=454) | Redução do Risco (%) (IC 95%) a | Valor de p |
| Estudo de 1 ano - fase III, análise agrupada | Dias até a 1ª exacerbação grave de asma | 282 b | 226 b | 21 (0, 38) | 0,0343 |
| Média do número de exacerbações grave de asma / pacienteano | 0,530 | 0,663 | 20 (0, 36) | 0,0458 | |
| Dias até o 1ª agravamento da asma | 315 b | 181 b | 31 (18, 42) | <0,0001 | |
| Média do número de agravamentos da asma/ paciente-ano | 2,145 | 2,835 | 24 (9, 37) | 0,0031 |
a Razão de risco, intervalo de confiança e valor-p foram obtidos do modelo de perigo proporcional Cox com apenas o tratamento como efeito. A porcentagem de redução do risco é 100 (1-razão de risco).
b Tempo para o primeiro evento: dias em tratamento quando 25% dos pacientes tiveram pelo menos uma exacerbação grave de asma / agravamento da asma.
Figura 6: Exacerbações graves de asma ao longo do estudo PrimoTinA-asma

- As taxas de resposta do questionário de controle da asma (ACQ), definido como porcentagem de paciente com melhora por pelo menos 0,5 pontos, foram significativamente maiores com Brometo de Tiotrópio (53,9% versus 46,9%; p=0,0427).
- A média da melhora em pontuação do questionário de Qualidade de Vida para Asma (AQLQ (S)) demonstrou que Brometo de Tiotrópio melhorou significativamente em comparação com o placebo na semana 24.
Nos 2 estudos Mezzo-TinA-asma de 6 meses com pacientes que eram sintomáticos em tratamento de manutenção com dose média de ICS, Brometo de Tiotrópio demonstrou melhoras significativas na função pulmonar comparativamente ao placebo, quando usado adicionalmente ao tratamento prévio.
- Na 24ª semana, a melhora significativa no VEF1 foi de 0,185 litros (IC 95%: 0,146 a 0,223 litros, p<0,0001) e a melhora no vale de VEF1 foi 0,146 litros (0,105 a 0,188 litros, p<0,0001), respectivamente. Os valores médios de pico e vale de VEF1 para salmeterol foram de 0,196 litros (IC 95%: 0,158 a 0,234 litros) e 0,114 litros (IC 95%: 0,073 a 0,155 litros), respectivamente.
- Brometo de Tiotrópio melhorou significativamente as taxas matutinas e vespertinas de pico de PEF (média matutina melhorada: 24L/min; IC 95%: 18 a 31L/min; p<0,0001; média vespertina melhorada: 23L/min; IC 95%: 17 a 30L/min; p<0,0001. A PEF matutina e vespertina de salmeterol comparativamente com o placebo foram: 25L/min (IC 95%: 19 a 31L/min) e 21L/min (IC 95%: 15 a 27L/min), respectivamente.
- Pacientes em tratamento com Brometo de Tiotrópio tiveram uma taxa de resposta no ACQ significativamente maior na 24ª semana em comparação aos pacientes que receberam placebo (Tabela 3).
Tabela 3: Respondedores ACQ em pacientes sintomáticos em tratamento com ICS (Estudo Mezzo TinA-asma)
| Estudo | Tratamento | Respondedores ACQ (%) | Valor de p* |
| Estudo de fase III de 24 semanas, análise agrupada | Placebo, adicional ao tratamento com ICS (N=518) | 57,7 | - |
| Brometo de Tiotrópio, adicional ao tratamento com ICS (N=513) | 64,3 | 0,0348 | |
| Salmeterol, adicional ao tratamento com ICS (N=535) | 66,5 | 0,0039 |
*Calculado como 2* valor de p no sentido correspondente ao testar a hipótese nula.
Na semana 12 do estudo GraziaTinA-asma em pacientes sintomáticos na manutenção do tratamento com baixa dose de ICS, Brometo de Tiotrópio mostrou melhora significativa na função pulmonar comparativamente ao placebo, quando adicional ao tratamento prévio. Na semana 12, a melhora na média do pico e vale de VEF1 foi de 0,128 litros (IC 95%: 0,057 a 0,199 litros, p<0,0005) e 0,122 litros (IC 95%: 0,049 a 0,194 litros, p<0,0010), respectivamente.
Pacientes pediátricos
O programa clínico fase III para asma persistente em pacientes pediátricos (1-17 anos) incluiu:
- Adolescentes (12 a 17 anos): estudo randomizado, duplo cego, controlado por placebo (de 1 ano e de 12 semanas, num total de 789 pacientes com asma (264 recebendo Brometo de Tiotrópio);
- Crianças de 6 a 11 anos: estudo randomizado, duplo cego, controlado por placebo (de 1 ano e outro de 12 semanas num total de 801 pacientes com asma (265 recebendo Brometo de Tiotrópio);
- Crianças de 1 a 5 anos: estudo randomizado, duplo cego, controlado por placebo, de duração de 12 semanas, num total de 101 pacientes com asma (31 recebendo Brometo de Tiotrópio).
Em todos estes estudos, os pacientes estavam em tratamento anterior com corticosteroides inalatórios.
Adolescentes (12 a 17 anos)
No estudo RubaTina- asma de duração de 1 ano em pacientes que estavam sintomáticos com tratamento de manutenção, com dose média de corticosteroides inalatórios, Brometo de Tiotrópio demonstrou melhora significativa na função pulmonar em comparação a placebo quando usado em adição à terapia de base.
- Na semana 24, melhorias médias no pico e vale de VEF1 foram 0,174 litros (IC 95%: 0,076 a 0,272 litros, p= 0,0005) e 0,117 litros (IC 95%: 0,010 a 0,223 litros, p = 0,0320), respectivamente.
- Na semana 24, Brometo de Tiotrópio aumentou significativamente o PEF de manhã e a noite (manhã 15,8 L/ min; IC 95%: 2,3, 29,3L/min, p =0,0214; noite 16,7 L/min; IC 95%: 3,4, 30,0L/min, p=0,0137).
- Os efeitos broncodilatadores de Brometo de Tiotrópio foram mantidos ao longo do período de 1 ano de administração sem evidência de taquifilaxia.
Figura 7: resposta da FEV1 durante 48 semanas no estudo RubaTina –asma

No estudo de 12 semanas PensieTina – asma em pacientes que eram sintomáticos no tratamento de manutenção com dose média de corticosteroides inalatórios em combinação com 1 ou mais medicações de controle, Brometo de Tiotrópio demonstrou melhoras na função pulmonar em comparação a placebo quando usado como tratamento adicional à terapia de base, no entanto as diferenças no pico e vale de VEF1 não foram estatisticamente significativas.
- Na semana 12, melhoras médias no pico e vale de VEF1 foram 0,090 litros (IC 95%: - 0,019 a 0,198 litros, p = 0,1039) e 0,054 litros (IC 95%: -0,061 a 0,168 litros, p = 0,3605), respectivamente.
- Na semana 12, Brometo de Tiotrópio melhorou significativamente o PEF da manhã e da noite (manhã 17,4 L/ min; IC 95%: 5,1 a 29,6 L/min; noite 17,6 L/ min; IC 95%: 5,9 a 29,6 L/ min).
Crianças de 6 a 11 anos
No estudo de 1 ano CanoTina-asma em pacientes que estavam sintomáticos em tratamento de manutenção com dose média de corticosteroides inalatórios, Brometo de Tiotrópio demonstrou melhora significativa na função pulmonar e no controle da asma em comparação a placebo, quando utilizado em adição à terapia de base.
- Na semana 24, melhoras médias no pico e vale de VEF1 foram 0,164 litros (IC 95%: 0,103 a 0,225 litros, p<0,0001) e 0,118 litros (IC 95%: 0,048 a 0,188 litros, p = 0,0010), respectivamente.
- Os efeitos broncodilatadores de Brometo de Tiotrópio foram mantidos ao longo do período de 1 ano de administração, sem evidência de taquifilaxia.
Figura 8: Resposta de FEV1 durante 48 semanas no estudo CanoTina –asma

No estudo de 12 semanas VivaTina – asma, em pacientes que estavam sintomáticos no tratamento de manutenção com corticosteroide inalatório dose média em combinação com 1 ou mais medicações de controle, Brometo de Tiotrópio demonstrou melhora significativa na função pulmonar em comparação a placebo, quando utilizado como adição à terapia de base.
- Na semana 12, melhoras médias no pico e vale de VEF1 foram 0,139 litros (IC 95%: 0,075 a 0,203 litros, p< 0,0001) e 0,087 litros (IC 95%: 0,019 a 0,154 litros, p= 0,0117), respectivamente.
Crianças de 1 a 5 anos
Um estudo randomizado de 12 semanas, duplo - cego, controlado por placebo fase II/III (NinoTina- asma) foi conduzido num total de 101 crianças (31 receberam Brometo de Tiotrópio) com asma em terapia de base com corticosteroides inalatórios. Um espaçador (Aerochamber® Plus Flow-Vu®) com máscara facial foi utilizado para administrar Brometo de Tiotrópio em 98 pacientes.
O objetivo primário do estudo foi segurança; avaliações de eficácia foram exploratórias.
O número de eventos adversos em asma foi mais baixo para Brometo de Tiotrópio em relação a placebo. Avaliações de eficácia exploratórias não demonstraram diferenças de Brometo de Tiotrópio em relação a placebo.
Referências Bibliográficas
1. Cornelissen P J G, Mueller A, Schaefer H G. A randomised, double-blind, double-dummy, placebocontrolled, crossover efficacy and safety comparison of 4-week treatment periods of two doses [5µg (2 actuations of 2.5µg) and 10µg (2 actuations of 5µg)] of tiotropium inhalation solution delivered by the Respimat inhaler, tiotropium inhalation powder capsule (18µg) delivered by the HandiHaler in patients with chronic obstructive pulmonary disease (COPD).
2. Van Andel A E, Korducki L. A randomised, double-blind, placebo-and active controlled, parallel group efficacy and safety comparison of 12-week treatment periods of two doses [5µg (2 actuations of 2.5µg) and 10µg (2 actuations of 5µg)] of tiotropium inhalation solution delivered by the Respimat inhaler, placebo and ipratropium bromide inhalation aerosol (MDI) in patients with chronic obstructive pulmonary disease (COPD).
3. Bateman, Eric, et al. "Efficacy and safety of tiotropium Respimat ® SMI in COPD in two 1-year randomized studies." International journal of chronic obstructive pulmonary disease5 (2010): 197.
4. Kerstjens HAM, Engel M, Dahl R, et al. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med 2012;367:1198-207.
5. Seibold W, Nottbohm A, Sigmund R, Sharma A. A Phase III randomised, double-blind, placebo-controlled, parallel-group trial to evaluate efficacy and safety of tiotropium inhalation solution delivered via Respimat ® inhaler (5 μg/day) over 48 weeks as add-on controller therapy on top of usual care in patients with severe persistent asthma (BI trial 205.416 &417 report).
6. Sharma A, Schmid M, Moroni-Zentgraf P, et al. Pharmacokinetics of tiotropium in asthma patients from three paediatric clinical trials. PA316 apresentado no 26º Congresso Anual da European Respiratory Society (ERS), 3-7 Set 2016, Londres.
7. Kerstjens, Huib AM, et al. Tiotropium or salmeterol as add-on therapy to inhaled corticosteroids for patients with moderate symptomatic asthma: two replicate, double-blind, placebo-controlled, parallel-group, activecomparator, randomised trials. The Lancet Respiratory Medicine 3.5 (2015): 367-376.
Características Farmacológicas
Farmacodinâmica
O Brometo de Tiotrópio é um agente antimuscarínico específico, de longa duração, comumente denominado de anticolinérgico. O Brometo de Tiotrópio apresenta afinidade similar aos subtipos de receptores muscarínicos M 1 ao M 5 . Nas vias aéreas, a inibição de receptores M 3 promove relaxamento da musculatura lisa. A natureza competitiva e reversível desse antagonismo foi demonstrada em estudos com receptores de origem humana e animal e em preparações de órgãos isolados. Nos estudos não clínicos in vitro e in vivo , os efeitos broncoprotetores foram dose-dependentes e duraram por mais de 24 horas. A longa duração do efeito é provavelmente devido à sua dissociação muito lenta dos receptores M 3 , apresentando uma meia-vida de dissociação significativamente maior que a observada com o ipratrópio. Por ser um anticolinérgico N-quaternário, o Brometo de Tiotrópio é topicamente bronco-seletivo quando administrado por inalação, demonstrando uma margem terapêutica aceitável antes de apresentar efeitos anticolinérgicos sistêmicos. A dissociação dos receptores M 2 é mais rápida que dos receptores M 3 ; o que, em estudos funcionais in vitro , levou à seletividade (controlada cineticamente) ao subtipo de receptor M 3 em relação ao M 2 . A elevada potência e lenta dissociação do receptor promovem broncodilatação importante e de longa duração nos pacientes com DPOC e asma.
A broncodilatação observada após a inalação de Brometo de Tiotrópio é fundamentalmente um efeito local (nas vias aéreas) e não um efeito sistêmico.
Farmacocinética
O Brometo de Tiotrópio é um composto de amônio quaternário não-quiral e é pouco solúvel em água. O Brometo de Tiotrópio está disponível como solução para inalação administrada com o inalador Respimat. Aproximadamente 40% da dose inalada é depositada nos pulmões, o órgão alvo, sendo a quantidade restante depositada no trato gastrintestinal. Alguns dos dados farmacocinéticos abaixo descritos foram obtidos com doses mais altas do que as recomendadas para tratamento.
Absorção
Após inalação da solução por voluntários jovens saudáveis, os dados da excreção urinária sugerem que aproximadamente 33% da dose inalada atinge a circulação sistêmica. As soluções orais de Brometo de Tiotrópio têm uma biodisponibilidade absoluta de 2-3%. Não se espera que os alimentos influenciem a absorção de Brometo de Tiotrópio pelas mesmas razões. As concentrações plasmáticas máximas do Brometo de Tiotrópio foram observadas 5 - 7 minutos após a inalação.
No estado de equilíbrio, os picos de níveis plasmáticos de Brometo de Tiotrópio em pacientes com DPOC foram de 10,5 pg/mL e diminuíram rapidamente de modo multi-compartimental. As concentrações plasmáticas no estado de equilíbrio foram 1,60 pg/mL.
A concentração plasmática de 5,15 pg/mL de Brometo de Tiotrópio no estado de equilíbrio foi obtida 5 minutos após administração da mesma dose para pacientes com asma.
Distribuição
A medicação tem uma ligação de 72% às proteínas plasmáticas e demonstra um volume de distribuição de 32 L/kg. As concentrações locais pulmonares não são conhecidas, mas a forma de administração sugere concentrações substancialmente superiores nos pulmões. Estudos em ratos demonstraram que o Brometo de Tiotrópio não atravessa a barreira hematoencefálica em extensão relevante.
Metabolização
O grau de metabolização do fármaco é pequeno. Este fato é evidenciado pela excreção urinária de 74% da substância inalterada após administração intravenosa a voluntários sadios jovens. O Brometo de Tiotrópio , um éster, é clivado de maneira não enzimática em álcool N-metilescopina e ácido ditienilglicólico, que não se ligam aos receptores muscarínicos.
Estudos in vitro com microssomos hepáticos e hepatócitos humanos sugerem que uma parcela do fármaco (<20% da dose administrada por via endovenosa) é metabolizada pela oxidação dependente de citocromo P450 e subsequente conjugação glutatiônica em uma variedade de metabólitos de fase II. Esta via enzimática pode ser inibida pelos inibidores do citocromo P450 2D6 (e 3A4), quinidina, cetoconazol e gestodeno. Dessa forma, os citocromos P450 2D6 e 3A4 estão envolvidos na via metabólica responsável pela eliminação da menor parte da dose. O Brometo de Tiotrópio , mesmo em concentrações superiores às terapêuticas, não inibe o citocromo P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A nos microssomos hepáticos humanos.
Eliminação
A meia-vida efetiva de Brometo de Tiotrópio varia entre 27 a 45 horas após a inalação por pacientes com DPOC. A meia-vida efetiva foi de 34 horas em pacientes com asma. A depuração total foi de 880 mL/min após uma administração intravenosa em voluntários sadios jovens. A administração endovenosa de Brometo de Tiotrópio é principalmente excretada de forma inalterada na urina (74%). Após administração da solução para inalação por pacientes com DPOC, a excreção urinária é 18,6 % (0,93 mcg) da dose, sendo o restante principalmente medicação não absorvida no intestino que é eliminada pelas fezes. Em pacientes com asma, 11,9% (0,595 mcg) da dose é excretada de forma inalterada na urina mais de 24 horas após a dose no estado de equilíbrio. A depuração renal de Brometo de Tiotrópio excede o clearance de creatinina, indicando secreção para a urina.
Após inalação crônica uma vez ao dia, o estado de equilíbrio farmacocinético foi alcançado até o dia 7, sem acúmulo a partir de então.
Linearidade/não linearidade
O Brometo de Tiotrópio apresenta farmacocinética linear dentro da faixa terapêutica independente da formulação.
Pacientes idosos
Assim como esperado para todos os fármacos excretados predominantemente por via renal, a idade avançada foi associada com uma diminuição da depuração renal de Brometo de Tiotrópio de 347 mL/min em pacientes com DPOC e idade inferior a 65 anos para 275 mL/min em pacientes com DPOC e idade superior ou igual a 65 anos). Isso não resultou num aumento correspondente nos valores de AUC 0–6, ss ou C max,ss .
Para pacientes com asma, não foram encontradas diferenças das exposições ao Brometo de Tiotrópio com a idade.
Pacientes pediátricos
Não foram observadas diferenças entre o pico e a exposição total ao Brometo de Tiotrópio em pacientes pediátricos (6 -17 anos) e pacientes adultos com asma. Em pacientes de 1 a 5 anos de idade com asma, a exposição total medida pela excreção urinária foi 52 a 60 % mais baixa que o observado em pacientes a partir de 6 anos com asma; os dados de exposição total quando ajustados para área de superfície corpórea foram comparáveis em todos os grupos etários.
Brometo de Tiotrópio foi administrado com um espaçador (Aerochamber ® ) em pacientes de 1 a 5 anos de idade.
Pacientes com insuficiência renal
Após a administração de Brometo de Tiotrópio uma vez ao dia até o estado de equilíbrio em pacientes com DPOC com insuficiência renal leve (CL CR 50-80 mL/min), resultou numa AUC 0-6,ss um pouco maior (entre 1,8 a 30% maior) e semelhantes C max comparado com pacientes com função renal normal (CL CR > 80 mL/min). Em pacientes com DPOC com insuficiência renal moderada a grave (CL CR <50 mL/min) a administração intravenosa de Brometo de Tiotrópio resultou na duplicação da exposição total (82% maior AUC 0-4h e 52% maior C max ) em comparação com pacientes com DPOC com função renal normal, o que foi confirmado pelas concentrações plasmáticas após inalação de pó seco.
Em pacientes asmáticos com insuficiência renal leve (CL CR 50-80 mL/min), a inalação do Brometo de Tiotrópio não resultou em aumentos relevantes na exposição quando comparados aos pacientes com função renal normal.
Pacientes com comprometimento hepático
Não é esperado que a insuficiência hepática tenha alguma influência relevante na farmacocinética do Brometo de Tiotrópio. O Brometo de Tiotrópio é predominantemente eliminado por via renal (74% em voluntários sadios jovens) e por clivagem simples não enzimática do éster para produtos inativos.
Como devo armazenar o Spiriva Respimat?
Mantenha em temperatura ambiente (15 ºC a 30 ºC). Não congelar.
Número de lote e datas de fabricação e validade: vide embalagem.
Descartar o conjunto frasco + inalador Respimat após 3 meses da inserção do frasco no inalador Respimat. Este dispositivo inalatório não deve ser reutilizado.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do medicamento
Spiriva é uma solução transparente e incolor para ser usada com o inalador Respimat.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Spiriva Respimat
M.S - 1.0367.0137
Farm. Resp.:
Ana Carolina Scandura Cardillo
CRF-SP 22440
Importado por:
Boehringer Ingelheim do Brasil Quím. e Farm. Ltda
Rod. Régis Bittencourt, km 286
Itapecerica da Serra – SP
CNPJ 60.831.658/0021-10
Fabricado por:
Boehringer Ingelheim Pharma GmbH & Co. KG.
Ingelheim am Rhein – Alemanha
SAC
0800 701 6633
Venda sob prescrição médica.