Lopinavir + Ritonavir Cristália
Bula do Medicamento - Farmacologia do Remédio
Lopinavir + Ritonavir Cristália, para o que é indicado e para o que serve?
O lopinavir + ritonavir é destinado, em combinação com outros medicamentos antirretrovirais, ao tratamento da infecção pelo vírus da Imunodeficiência Humana ( HIV ). A indicação é baseada em análises dos níveis no plasma de RNA HIV (carga viral do HIV no sangue) e células CD4. Até o momento, não há estudos avaliando o efeito do lopinavir + ritonavir na progressão da infecção pelo HIV.
Como o Lopinavir + Ritonavir Cristália funciona?
O lopinavir + ritonavir é um medicamento pertencente à classe dos inibidores de protease que contém lopinavir e ritonavir e, em combinação com outros agentes antirretrovirais, é indicado para o tratamento de infecção por HIV.
O lopinavir + ritonavir não cura a infecção por HIV. O medicamento tem por objetivo controlar a quantidade de vírus e promover a melhora do sistema de defesa imunológica do organismo.
O lopinavir + ritonavir reduz a quantidade de HIV no sangue e aumenta o número de células de defesa do organismo.
Durante o tratamento, outras infecções podem se desenvolver, as chamadas oportunistas, ou mesmo outras complicações associadas à AIDS (Síndrome da Imunodeficiência Adquirida).
O mecanismo de ação do lopinavir + ritonavir é inibir a multiplicação do HIV dentro das células, impedindo a ação da enzima protease. A inibição da protease leva à formação de um vírus imaturo, não infeccioso, ou seja, que não é capaz de entrar em outra célula para se multiplicar
O lopinavir + ritonavir é um medicamento de uso contínuo e, portanto, assim que atingida a concentração indicada no organismo, o medicamento permanecerá em constante ação.
Estudos clínicos demonstraram que a administração de lopinavir + ritonavir em pacientes adultos duas vezes ao dia ou uma única vez ao dia proporcionam eficácia antiviral semelhante. A escolha entre o intervalo entre as tomadas deve ser orientada pelo médico.
A administração de lopinavir + ritonavir na apresentação de 100 mg + 25 mg uma única vez ao dia não foi estudada em pacientes pediátricos.
Quais as contraindicações do Lopinavir + Ritonavir Cristália?
O lopinavir + ritonavir é contraindicado, ou seja, não deve ser usado, em pacientes com hipersensibilidade (alergia) conhecida ao lopinavir/ritonavir ou a qualquer componente presente na formulação.
O lopinavir + ritonavir não deve ser administrado em combinação a outros medicamentos cujo mecanismo de eliminação seja o mesmo que o seu e cuja alta concentração no sangue esteja associada a reações adversas graves.
Os medicamentos que não devem ser administrados com o lopinavir + ritonavir são os seguintes: antagonistas alfa1- adrenoceptores ( cloridrato de alfuzosina ), antibióticos ( ácido fusídico ), agentes antigotosos (colchinha em pacientes com insuficiência renal e/ou hepática), benzodiazepínicos (midazolam, triazolam); derivados do ergot (ergotamina, di hidroergotamina, ergonovina e metilergonovina); agentes que atuam na motilidade gastrintestinal (cisaprida); antihistamínicos (astemizol, terfenadina), antipsicóticos (blonanserina, lurasidona e pimozida ), produto herbais (erva de São João – Hypericum perforatum ), antivirais de ação direta (DAA) para o tratamento da Hepatite C (elbasvir, grazoprevir) inibidores de HMG-CoA redutase ( lovastatina , sinvastatina ), agonistas de longa duração de beta-adrenoceptores ( salmeterol ), inibidores da enzima PDE5 (sildenafila* - somente quando utilizada para tratamento da hipertensão arterial pulmonar).
*Ver seção “ Quais cuidados devo ter ao usar o Lopinavir + Ritonavir Cristália? para uso da sildenafila em pacientes com disfunção erétil .
Como usar o Lopinavir + Ritonavir Cristália?
Os comprimidos revestidos de lopinavir + ritonavir podem ser tomados com ou sem alimentação.
Posologia para adultos
A dose recomendada de lopinavir + ritonavir comprimidos revestidos é:
- Dois comprimidos de 200/50 mg (400/100 mg) duas vezes ao dia com ou sem alimentação; Ou
- Quatro comprimidos de 200/50 mg (800/200 mg) uma única vez ao dia com ou sem alimentação em pacientes sem tratamento prévio ou naqueles com experiência prévia e com menos que três mutações associadas ao lopinavir.
Não há dados suficientes para suportarem a administração em dose única diária de lopinavir + ritonavir em pacientes com três ou mais mutações associadas ao lopinavir.
O lopinavir + ritonavir não deve ser administrado uma única vez ao dia em combinação com carbamazepina , fenobarbital e fenitoína .
A dose única diária é uma alternativa à terapia convencional de dois comprimidos duas vezes ao dia.
Portanto, o médico decidirá se você deve tomar a dose recomendada por ele uma vez ao dia ou dividi-la em duas tomadas diárias.
Terapia combinada - efavirenz , nevirapina , amprenavir ou nelfinavir
Um aumento de dose de lopinavir + ritonavir para 500/125 mg duas vezes ao dia (2 comprimidos de lopinavir + ritonavir 200/50 mg + 1 comprimido de lopinavir + ritonavir 100/25 mg) deve ser considerado quando houver coadministração de lopinavir + ritonavir com efavirenz, nevirapina, amprenavir ou nelfinavir em pacientes com tratamento antirretroviral prévio, nos quais uma diminuição à susceptibilidade ao lopinavir é clinicamente suspeita (através de histórico de tratamento ou evidência laboratorial), conforme indicação médica.
O lopinavir + ritonavir 200 mg + 50 mg não deve ser administrado uma única vez ao dia em combinação com efavirenz, nevirapina, amprenavir ou nelfinavir.
A administração de lopinavir + ritonavir 200 mg + 50 mg uma única vez ao dia em combinação com indinavir e saquinavir não foi estudada.
Posologia para pacientes pediátricos
Em geral, 91% das crianças entre 06 e 11 anos são capazes de deglutir comprimidos pequenos. No entanto, fica a critério do médico prescritor a escolha pela apresentação que mais se adequa ao paciente pediátrico: solução oral ou comprimidos.
O lopinavir + ritonavir não deve ser administrado uma vez ao dia em pacientes pediátricos.
A dose para adultos de lopinavir + ritonavir comprimidos revestidos duas vezes ao dia sem administração combinada com efavirenz, nevirapina ou nelfinavir pode ser usada em crianças com 35 kg ou mais, ou com uma Área de Superfície Corporal (ASC) maior ou igual a 1,4 m². Para crianças pesando menos que 35 kg ou mais, ou com ASC entre 0,6 e 1,4 m² e capazes de engolir comprimidos, seguir tabelas abaixo para definição da dose a ser administrada.
Área de Superfície Corporal
A tabela abaixo apresenta o guia para doses pediátricas de lopinavir + ritonavir 100 mg + 25 mg baseando-se na Área de Superfície Corporal:
| Guia para Doses Pediátricas | |
| Área de Superfície Corporal (m²) | Número de comprimidos de lopinavir + ritonavir 100 mg + 25 mg duas vezes ao dia |
| > 0,6 a < 0,9 | 2 comprimidos (200/50 mg) |
| > 0,9 a < 1,4 | 3 comprimidos (300/75 mg) |
| > 1,4 | 4 comprimidos (400/100 mg) |
A Área de Superfície Corporal (ASC) pode ser calculada a partir da seguinte equação:
ASC (m²) = √ (Altura (cm) X Peso (kg) / 3600).
Terapia combinada - efavirenz, nevirapina, nelfinavir ou amprenavir
A tabela a seguir contém um guia de doses de lopinavir + ritonavir 100 mg + 25 mg baseado na Área de Superfície Corporal quando utilizado em combinação com efavirenz, nevirapina, nelfinavir ou amprenavir em crianças.
| Guia para Doses Pediátricas com uso combinado com efavirenz, nevirapina, nelfinavir ou amprenavir | |
| Área de Superfície Corporal (m²) | Número de comprimidos de lopinavir + ritonavir 100 mg + 25 mg duas vezes ao dia |
| > 0,6 a < 0,8 | 2 comprimidos (200/50 mg) |
| > 0,8 a < 1,2 | 3 comprimidos (300/75 mg) |
| > 1,2 a < 1,4 | 4 comprimidos (400/100 mg) |
| > 1,4 | 5 comprimidos (500/125 mg) |
Peso
A tabela abaixo apresenta o guia para doses pediátricas de lopinavir + ritonavir 100 mg + 25 mg baseando-se no peso do paciente:
| Guia para Doses Pediátricas | |
| Peso (Kg) | Número de comprimidos de lopinavir + ritonavir 100 mg + 25 mg duas vezes ao dia |
| 7 a < 15 Kg | Não é recomendada a administração de comprimidos. Utilizar solução oral |
| 15 a < 22 Kg | 2 comprimidos |
| > 22 a 35 Kg | 3 comprimidos |
| > 35 Kg | 4 comprimidos* |
*Como alternativa, dois comprimidos de lopinavir + ritonavir 200 mg + 50 mg podem ser administrados a estes pacientes.
Terapia concomitante - efavirenz, nevirapina, nelfinavir ou amprenavir
A tabela a seguir contém um guia de doses de lopinavir + ritonavir 100 mg + 25 mg baseado no peso do paciente quando utilizado em combinação com efavirenz, nevirapina, nelfinavir ou amprenavir em crianças.
| Guia para Doses Pediátricas com uso combinado com efavirenz, nevirapina, nelfinavir ou amprenavir | |
| Peso (Kg) | Número de comprimidos de lopinavir + ritonavir 100 mg + 25 mg duas vezes ao dia |
| 7 a < 15 Kg | Não é recomendada a administração de comprimidos. Utilizar solução oral |
| 15 a 20 Kg | 2 comprimidos |
| > 20 a 30 Kg | 3 comprimidos |
| > 30 a 45 Kg | 4 comprimidos* |
| > 45 Kg | 5 comprimidos |
*Como alternativa, dois comprimidos de lopinavir + ritonavir 200 mg + 50 mg podem ser administrados a estes pacientes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido ou mastigado.
O que eu devo fazer quando esquecer de usar o Lopinavir + Ritonavir Cristália?
Caso esqueça de tomar uma dose de lopinavir + ritonavir, tome-a tão logo se lembre. Se estiver próximo à dose seguinte, espere e tome a dose no horário previsto. Não duplique a dose seguinte.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Lopinavir + Ritonavir Cristália?
Gerais
Atualmente não há dados demonstrando que a terapia com o lopinavir + ritonavir possa reduzir o risco de transmissão do HIV a outras pessoas pelo contato sexual.
O lopinavir + ritonavir não deve ser utilizado com certos tipos de medicamentos, pois podem ocorrer efeitos colaterais sérios que podem levar à morte.
Para se prevenir a transmissão do HIV e de outras doenças sexualmente transmissíveis ( DST ), você deve usar corretamente a camisinha nas relações sexuais e apenas agulhas e seringas descartáveis.
Para evitar que o HIV se transmita da mãe para o filho, todas as gestantes devem começar o pré-natal o mais cedo possível e fazer o teste para o HIV.
Diabetes mellitus /hiperglicemia (excesso de glicose no sangue)
Foi relatado aparecimento ou piora de diabetes mellitus pré-existente e hiperglicemia em pacientes infectados por HIV. Alguns pacientes necessitaram iniciar ou ajustar as doses de insulina ou de medicamentos para controlar a taxa de açúcar no sangue (hipoglicemiantes orais) para o tratamento destes efeitos adversos. Nos pacientes que descontinuaram a terapia com inibidores de protease, a hiperglicemia persistiu em alguns casos. Deve-se considerar a monitoração da glicemia.
Pancreatite
Foi observada pancreatite (inflamação no pâncreas) em pacientes recebendo lopinavir + ritonavir. Foram observados alguns casos de óbito. A elevação acentuada de triglicérides (gordura no sangue) é um fator de risco para o desenvolvimento de pancreatite. Pacientes com doença avançada pelo HIV podem apresentar risco aumentado de elevação de triglicérides e pancreatite, e pacientes com história de pancreatite podem apresentar risco aumentado de ter pancreatite novamente.
Insuficiência hepática (do fígado )
O lopinavir + ritonavir é transformado, para posterior eliminação, principalmente pelo fígado. Portanto, deve-se ter cuidado quando este produto é administrado a pacientes com falha no funcionamento do fígado. Há relatos pós-comercialização do produto de disfunção do fígado, incluindo algumas mortes, geralmente ocorridas em pacientes com AIDS em fase avançada, utilizando múltiplos medicamentos concomitantemente e em vigência de hepatite crônica ou cirrose . Não foi estabelecida uma relação causal com a terapia de lopinavir + ritonavir.
Foi relatado aumento das enzimas do fígado, com ou sem níveis elevados de bilirrubina, após 07 dias do início da terapia de lopinavir + ritonavir em conjunto com outros agentes antirretrovirais. Em alguns casos, a disfunção do fígado foi grave; no entanto, não foi estabelecida uma relação causal definitiva com a terapia de lopinavir + ritonavir.
Deve ser considerado um monitoramento frequente de enzimas do fígado nestes pacientes, principalmente nos primeiros meses de tratamento com o lopinavir + ritonavir.
Resistência cruzada
Foram observados vários graus de resistência cruzada entre inibidores de protease, que é a classe de medicamentos a qual pertence o lopinavir + ritonavir. O efeito do tratamento com o lopinavir + ritonavir sobre a eficácia de outros inibidores de protease administrados conjuntamente está sendo investigado.
Hemofilia (distúrbio na coagulação do sangue)
Há relatos de sangramento aumentado, incluindo hematomas na pele e hemartrose (sangramento para dentro da articulação) espontâneas, em pacientes com hemofilia tipo A e B tratados com inibidores de protease. Em alguns pacientes foi administrado fator VIII adicional. Em mais da metade dos casos relatados, o tratamento com inibidores de protease foi mantido ou reiniciado. Não foram estabelecidos o mecanismo de ação nem a relação causal entre a terapia com inibidores da protease e estes eventos.
Efeitos no eletrocardiograma
O lopinavir + ritonavir mostrou causar discreta alteração no eletrocardiograma em alguns pacientes. O lopinavir + ritonavir deve ser utilizado com cautela em pacientes com insuficiência cardíaca e alterações do ritmo cardíaco.
Redistribuição de gordura
Foi observada redistribuição ou acúmulo de gordura no corpo, incluindo obesidade central, aumento de gordura dorso cervical, emagrecimento das extremidades e da face e aumento das mamas e aparência cushingóide (face arredondada) em pacientes que receberam medicamento para tratar o HIV (terapia antirretroviral). O mecanismo e as consequências destes eventos a longo prazo são desconhecidos até o presente momento. Não foi estabelecida uma relação causal.
Elevação de lipídeos
O tratamento com o lopinavir + ritonavir resultou em aumentos da concentração de colesterol total e triglicérides (gordura no sangue). Devem ser realizados testes de colesterol e triglicérides antes de iniciar a terapia com o lopinavir + ritonavir e periodicamente durante o tratamento. Veja na seção Inibidores da HMG-CoA redutase (como pravastatina, fluvastatina, atorvastatina , lovastatina e sinvastatina), informações adicionais sobre interações medicamentosas potenciais de lopinavir + ritonavir com esse grupo de medicamentos.
Síndrome da Reconstituição Imunológica
Tal síndrome foi relatada em pacientes infectados por HIV tratados com terapia antirretroviral com diversos medicamentos, incluindo lopinavir + ritonavir. Durante a fase inicial da terapia antirretroviral combinada, quando o sistema imunológico reage, os pacientes podem desenvolver uma resposta inflamatória a infecções assintomáticas ou a infecções oportunistas latentes (como infecção causada por Mycobacterium avium , citomegalovírus, pneumonia causada por Pneumocystis jiroveci pneumonia, ou tuberculose ), podendo necessitar de avaliação e tratamentos adicionais.
Alterações autoimunes [como Doença de Graves (doença que afeta o funcionamento da tireoide ), polimiosite (doença inflamatória que afeta os músculos) e Síndrome de Guillain-Barré (doença aguda associada à fraqueza muscular e paralisia)] também foram reportadas durante a fase de reconstituição imunológica, no entanto, o tempo de início é muito variável e pode ocorrer muitos meses após o início do tratamento.
Atenção: o uso incorreto causa resistência do vírus da AIDS e falha no tratamento.
Quais as reações adversas e os efeitos colaterais do Lopinavir + Ritonavir Cristália?
Adultos
O evento adverso mais comum associado ao uso de lopinavir + ritonavir foi a diarréia, geralmente de leve a moderada intensidade.
As seguintes reações adversas, de intensidade moderada a grave, com possível ou provável relação com o uso de lopinavir + ritonavir foram relatados por frequência de gravidade:
Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento)
- Infecções e infestações: infecção no trato respiratório superior;
- Alterações gastrintestinais: diarreia , náusea.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
- Infecções e infestações: infecção no trato respiratório inferior, infecções de pele incluindo celulites (infecção/inflamação da pele), foliculites (infecção dos folículos pilosos causadas por bactérias) e furunculose (aparecimento recorrente de furúnculos);
- Alterações no sangue e sistema linfático: anemia , leucopenia (diminuição dos glóbulos brancos) e neutropenia (quantidade de neutrófilos diminuída no sangue), linfadenopatia (aumento dos gânglios linfáticos);
- Alterações no sistema imunológico: hipersensibilidade, incluindo urticária (alergia de pele) e angioedema (inchaço similar à urticária, porém, por baixo da pele);
- Alterações na nutrição e metabolismo: alterações na glicose sanguínea, incluindo diabetes mellitus , hipertrigliceridemia (aumento do triglicérides no sangue), hipercolesterolemia (alto nível de colesterol no sangue), diminuição do peso e diminuição do apetite;
- Alterações psiquiátricas: ansiedade ;
- Alterações no sistema nervoso: cefaleia ( dor de cabeça ), incluindo enxaqueca, neuropatia, incluindo neuropatia periférica (inflamação dos nervos periféricos), vertigem ( tontura ), insônia ;
- Alterações vasculares: hipertensão ( pressão alta );
- Alterações gastrintestinais: vômito , doença do refluxo gastroesofágico (DRGE), gastroenterite (infecção estomacal e intestinal) e colite (inflamação no intestino), dor abdominal (superior e inferior), distensão abdominal, pancreatite (inflamação do pâncreas), dispepsia ( indigestão ), hemorroidas e flatulência (gases intestinais);
- Alterações hepatobiliares: hepatite (inflamação no fígado), incluindo aumentos das enzimas do fígado aspartato aminotransferase (AST), alanina aminotransferase (ALT) e gama glutamil tansferase ( GGT );
- Alterações na pele e tecido subcutâneo: lipodistrofia adquirida (alteração na distribuição de gordura), incluindo emagrecimento facial, rash , incluindo rash maculopapular (vermelhidão na pele), dermatite / rash , incluindo eczema (pele áspera) e dermatite seborreica (doença de pele que ataca principalmente o couro cabeludo), suores noturnos, prurido (coceira);
- Alterações no tecido conectivo e musculoesquelético: mialgia (dor nos músculos), dor musculoesquelética, incluindo artralgia (dor nas articulações) e dor nas costas , alterações musculares como fraqueza e espasmos;
- Alterações renais e urinárias: insuficiência renal (mau funcionamento dos rins);
- Alterações no sistema reprodutivo e mamas: disfunção erétil, alterações menstruais como amenorreia (ausência de menstruação), menorragia (menstruação extremamente abundante ou prolongada);
- Alterações gerais e nas condições de administração: fadiga , incluindo astenia (fraqueza).
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
- Alterações no sistema imunológico: síndrome da reconstituição imune;
- Alterações endócrinas: hipogonadismo (secreção inadequada de testosterona pelos testículos), síndrome de Cushing ;
- Alterações na nutrição e metabolismo: aumento de peso, aumento de apetite, acidose láctica, desidratação , anorexia (perda do apetite);
- Alterações psiquiátricas: depressão , sonhos anormais, diminuição da libido;
- Alterações no sistema nervoso: evento cerebrovascular, convulsão , ageusia (ausência ou diminuição do paladar), tremor, parestesia (sensações cutâneas subjetivas);
- Alterações nos olhos: deficiência visual;
- Alterações no ouvido e labirinto: tinido, tontura;
- Alterações cardíacas: aterosclerose (formação de placas na parede das artérias do coração), como infarto do miocárdio, bloqueio atrioventricular, insuficiência da válvula tricúspide;
- Alterações vasculares: trombose venosa profunda, angiopatia (doença dos vasos sanguíneos);
- Alterações gastrointestinais: hemorragia gastrointestinal, incluindo hemorragia retal, úlcera gastrointestinal, duodenite (inflamação do duodeno) e gastrite , estomatite (inflamação da boca ou gengivas) e úlceras na boca, incontinência fecal, constipação ( prisão de ventre ), boca seca, alterações nas fezes;
- Alterações hepatobiliares: esteatose hepática (acúmulo de gordura no fígado), hepatomegalia (tamanho do fígado aumentado), colangite (inflamação das vias biliares);
- Alterações na pele e tecido subcutâneo: acne , alopecia ( queda de cabelo ), capilarite (inflamação dos vasos capilares), vasculite (inflamação nos vasos sanguíneos);
- Alterações no tecido conectivo e musculoesquelético: rabdomiólise (destruição muscular), osteonecrose (necrose do osso);
- Alterações renais e urinárias: nefrite (inflamação nos rins), hematúria (sangue na urina);
- Investigação: aumento das concentrações do medicamento;
- Alterações gerais e relacionadas ao local de administração: dor, dor no peito , febre e edema (inchaço).
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
- Infecções e infestações: gripe , otite média (inflamação nos ouvidos), abscesso perineal (abscessos próximos a regiões genitais), sialodenite (inflamação nas glândulas salivares), infecção viral e infeção bacteriana;
- Alterações no sangue e sistema linfático: esplenomegalia (aumento do volume do baço);
- Alterações endócrinas: hipotireoidismo (diminuição de funcionamento da tireoide);
- Alterações na nutrição e metabolismo: hiperuricemia (presença de níveis altos de ácido úrico no sangue), hipocolesterolemia (presença de baixo nível de colesterol no sangue), hipofosfatemia (nível baixo de fosfato no sangue), hipovitaminose (quantidade reduzida de vitaminas no sangue), lipomatose (excesso de tecido adiposo localizado em certas regiões do corpo);
- Alterações psiquiátricas: estado confusional, labilidade afetada, pensamentos anormais, agitação, desorientação e variações de humor;
- Alterações no sistema nervoso: amnesia (perda da memória), ataxia (dificuldade para caminhar), encefalopatia (alterações cerebrais), paralisia facial , distúrbio extrapiramidal, discinesia (falta de coordenação motora), hipertonia (contratura muscular);
- Alterações nos olhos: distúrbios visuais;
- Alterações no ouvido e labirinto: hiperacusia (hipersensibilidade a certas faixas de som);
- Alterações cardíacas: palpitação;
- Alterações vasculares: veia varicosa e hipotensão ortostática (queda da pressão);
- Alterações gastrintestinais: esofagite (inflamação do esôfago), disfagia (dificuldade de deglutição), eructação, periodontite (inflamação nas gengivas);
- Alterações hepatobiliares: colecistite (inflamação da vesícula biliar) e “amolecimento” do fígado;
- Alterações na pele e tecido subcutâneo: pele seca , alterações nas unhas, descoloração da pele, úlceras cutâneas (feridas na pele) e estrias ;
- Alterações no tecido conectivo e musculoesquelético: osteoartrite (doença degenerativa das articulações), artropat;
- Alterações respiratórias, toráxicas e do mediastino: asma , dispneia (falta de ar), tosse e edema pulmonar ;
- Alterações renais e urinárias: litíase renal (pedra nos rins), alteração na urina, odor anormal da urina;
- Alterações no sistema reprodutivo: aumento das mamas, ginecomastia (crescimento das mamas nos homens);
- Alterações gerais e relacionadas ao local de administração: dor no peito, calafrios, cisto , edema (inchaço) periférico, interação entre medicamentos e dor nas extremidades;
- Neoplasmas benignos, malignos e inespecíficos: tumores benignos de pele e neoplasma.
Pacientes pediátrico
Em crianças com 02 anos de idade ou mais, o perfil de eventos adversos vistos durante o estudo clínico em pacientes pediátricos foi similar aqueles apresentados pelos pacientes adultos.
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Infecção por vírus, disgeusia (distorção ou diminuição do senso do paladar), constipação (prisão de ventre), vômito, pancreatite (inflamação do pâncreas), hepatomegalia (tamanho do fígado aumentado), rash , pele seca e febre.
Experiência pós-comercialização
Hepatite (inflamação do fígado) e raramente icterícia (coloração amarela da pele e olhos) foram relatadas em pacientes que utilizaram o lopinavir + ritonavir na presença ou ausência de fatores de risco para hepatite.
Necrólise epidérmica tóxica, Síndrome de Stevens-Johnson, eritema multiforme, bradiarritmia (frequência cardíaca lenta), foram relatados após a comercialização de lopinavir + ritonavir.
Informe seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Uso em crianças
Os perfis de segurança e ação do medicamento não foram estabelecidos para pacientes com menos de 06 meses de idade. Em pacientes infectados pelo HIV com idades entre 06 meses e 18 anos, o perfil de reações adversas observado durante um estudo clínico foi semelhante ao observado em pacientes adultos. O lopinavir + ritonavir não deve ser administrado uma vez ao dia na população pediátrica.
Uso em idosos
Os estudos clínicos com lopinavir + ritonavir não incluíram um número suficiente de indivíduos com mais de 65 anos para determinar se estes respondem diferentemente ao tratamento em relação a indivíduos mais jovens.
Em geral, deve-se ter cuidado na administração e monitoramento de lopinavir + ritonavir em pacientes idosos devido à maior frequência de função hepática (fígado), renal (rins) ou cardíaca diminuídas e de doenças ou outros tratamentos medicamentosos concomitantes.
Gravidez, fertilidade e reprodução
O lopinavir + ritonavir deve ser usado durante a gravidez somente quando, na opinião do médico, os benefícios potenciais claramente justificarem os possíveis riscos.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Uso na lactação
Por causa do potencial de transmissão do HIV e possíveis reações adversas de lopinavir + ritonavir, as mães devem ser instruídas a não amamentar enquanto estiverem recebendo o lopinavir + ritonavir. É desconhecido se o lopinavir é excretado no leite humano.
Uso em pacientes com insuficiência renal
O lopinavir não foi estudado em pacientes com insuficiência renal (dos rins), entretanto, não são esperadas alterações nesta população de pacientes.
Uso em pacientes com insuficiência hepática
Doses múltiplas de lopinavir + ritonavir em pacientes coportadores de HIV e Vírus da Hepatite C (HCV) com insuficiência hepática (do fígado) leve à moderada, resultaram em aumento de lopinavir no sangue quando comparados com pacientes portadores de HIV com função hepática normal. O lopinavir + ritonavir não foi estudado em pacientes com insuficiência hepática grave.
Apresentações do Lopinavir + Ritonavir Cristália
Comprimidos revestidos para uso via oral
200 mg + 50 mg (lopinavir/ritonavir)
Embalagem com 120 comprimidos revestidos.
Uso oral.
Uso adulto e pediátrico acima de 6 meses de idade*.
Medicamento Genérico Lei nº 9.787, de 1999.
*Crianças capazes de deglutir comprimidos.
Qual a composição do Lopinavir + Ritonavir Cristália?
Cada comprimido revestido (lopinavir + ritonavir) 200 + 50 mg contém:
| Lopinavir | 200 mg |
| Ritonavir | 50 mg |
Excipientes: copovidona, dióxido de silício, laurato de sorbitana, estearilfumarato de sódio, hipromelose , macrogol, dióxido de titânio e óxido férrico.
Superdose: o que acontece se tomar uma dose do Lopinavir + Ritonavir Cristália maior do que a recomendada?
A experiência em casos de superdosagem de lopinavir + ritonavir é limitada.
Em caso de superdosagem, cuidados médicos são primordiais. O tratamento envolve medidas médicas de suporte, como monitoramento dos sinais vitais (pulso, pressão, respiração) e observação do paciente.
Não há antídoto específico para estes casos.
Se indicado, pode ser recomendada lavagem gástrica ou indução de vômitos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Lopinavir + Ritonavir Cristália com outros remédios?
- Agentes antigotosos: interações medicamentosas fatais ou de risco à vida foram reportadas em pacientes tratados com colchinha e inibidores fortes de CYP3A4 como ritonavir;
- Antimicobacterianos: rifampicina não deve ser utilizada concomitantemente ao lopinavir + ritonavir por causa da grande redução que ocorre nas concentrações de lopinavir, o que pode diminuir significantemente seu efeito terapêutico. A coadministração de bedaquilina e lopinavir + ritonavir pode aumentar o risco de reações adversas relacionadas à bedaquilina. A bedaquilina deve ser usada cautelosamente com lopinavir + ritonavir, ou seja, somente quando, na opinião do médico, o benefício da coadministração for superior ao risco. A coadiministração de delamide com um potente inibidor da CYP3A (lopinavir/ritonavir) pode aumentar ligeiramente a exposição ao metabólito delamanide, que tem sido associada com o prolongamento do intervalo QTc. Portanto, se a coadiministração de delaminide com lopinavir/ritonavir é considerada necessária, é recomendada a monitorização frequente por eletrocardiograma (ECG) durante todo o período de tratamento com delamanide;
- Antipsicóticos: deve-se ter cautela no uso concomitante de lopinavir + ritonavir e quetiapina . Devido à inibição da enzima CYP3A por lopinavir / ritonavir, espera-se um aumento das concentrações de quetiapina, podendo levar a efeitos tóxicos relacionados a este antipsicótico ;
- Corticosteróides : o uso concomitante de lopinavir + ritonavir e fluticasona (inalatória, injetável ou intranasal), budesonida , triancinolona ou outro glicocorticoide que é metabolizado pela enzima CYP3A4, não é recomendado a menos que os benefícios potenciais do tratamento sobreponham os riscos dos efeitos sistêmicos dos corticosteróides, incluindo Síndrome de Cushing (aumento de cortisol no sangue) e supressão adrenal (diminuição da atividade da glândula adrenal). O uso concomitante de propionato de fluticasona e lopinavir + ritonavir pode aumentar a concentração de propionato de fluticasona e reduzir os níveis sanguíneos de cortisol. Efeitos dos corticosteróides, incluindo Síndrome de Cushing e supressão adrenal foram reportados quando houve a administração combinada a propionato de fluticasona ou budesonida ou triancinolona injetável;
- Inibidores de PDE5: a coadministração de lopinavir + ritonavir com avanafil não é recomendada. Deve-se ter cautela ao prescrever sildenafila, tadalafila e vardenafila para o tratamento de disfunção erétil em pacientes recebendo lopinavir + ritonavir. É esperado que a coadministração de lopinavir + ritonavir e estas substâncias aumente a concentração destes agentes, o que pode levar ao aumento de reações adversas, como hipotensão e ereção prolongada. O uso concomitante de sildenafila e lopinavir + ritonavir é contraindicado em casos de hipertensão (pressão alta) arterial pulmonar;
- Produtos fitoterápicos : erva de São João ( Hypericum perforatum ) pode reduzir substancialmente a concentração de lopinavir e de outros inibidores de protease e, portanto, o uso concomitante não é indicado. Esta associação pode resultar em perda do efeito terapêutico e desenvolvimento de resistência ao lopinavir ou à classe de inibidores de protease;
- Inibidores da HMG-CoA redutase: o uso concomitante de lovastatina ou sinvastatina e lopinavir + ritonavir é contraindicado. Deve-se ter cautela ao utilizar inibidores de protease, como lopinavir + ritonavir, juntamente à rosuvastatina ou outros inibidores de HMG-CoA redutase, tais como a atorvastatina, já que esta combinação pode aumentar o potencial para reações graves, como a miopatia, incluindo rabdomiólise (destruição muscular);
- Tipranavir : a administração concomitante de lopinavir + ritonavir e tipranavir com baixa dose de ritonavir não é recomendada.
O lopinavir + ritonavir é metabolizado (transformado) no fígado por uma enzima chamada CYP3A. Quando outros medicamentos são também metabolizados da mesma forma, podem ocorrer efeitos colaterais decorrentes do aumento ou diminuição dos níveis do fármaco. Exemplos de medicamentos metabolizados pela enzima CYP3A: bloqueadores de canal de cálcio derivados da di-hidropiridina, inibidores da HMG-CoA redutase, imunossupressores e inibidores da enzima PDE5 (sildenafila, tadalafila e vardenafila).
Medicamentos com importante potencial de interação
- Antivirais de ação direta (DAA) para o tratamento da Hepatite C – boceprevir (inibidor da protease do HCV): a administração concomitante de boceprevir e lopinavir/ritonavir resultou na diminuição de broceprevir e lopinavir no sangue. A coadministração de broceprevir e lopinavir/ritonavir não é recomendada;
- Atorvastatina: quando a administração em conjunto com atorvastatina estiver indicada, deve-se utilizar a menor dose possível. As interações com pravastatina e fluvastatina não são esperadas. Se houver indicação de tratamento combinado de lopinavir + ritonavir com um inibidor da HMG-CoA redutase, recomenda-se utilizar pravastatina ou fluvastatina;
- Bedaquilina: a administração de bedaquilina com lopinavir + ritonavir pode aumentar a concentração de bedaquilina no sangue. A bedaquilina deve ser usada cautelosamente com lopinavir + ritonavir, ou seja, somente quando, na opinião do médico, o benefício da coadministração for superior ao risco;
- Lovastatina e sinvastatina: os inibidores da HMG-CoA redutase, medicamentos que atuam na redução do colesterol, tais como a lovastatina e sinvastatina, podem apresentar um aumento acentuado de suas concentrações plasmáticas quando administrados juntamente ao lopinavir + ritonavir;
Considerando que as concentrações aumentadas de inibidores da HMG-CoA redutase podem causar alterações nos músculos, incluindo a destruição muscular, a combinação desses medicamentos com o lopinavir + ritonavir é contraindicada; - Contraceptivos orais e adesivos: considerando que os níveis de etinilestradiol podem ser reduzidos, deve-se utilizar um método contraceptivo alternativo ou adicional quando houver indicação de uso de lopinavir + ritonavir juntamente a contraceptivos orais e adesivos à base de estrógeno;
- Propionato de fluticasona (inaltória, injetável ou intranasal), budesonida, triancinolona: o uso concomitante de propionato de fluticasona, ou outro glicocorticoide que é metabolizado pela CYP3A4, como a budesonida, e o lopinavir + ritonavir não é recomendado a menos que na opinião do médico, os benefícios potenciais do tratamento sobreponham os riscos dos efeitos sistêmicos dos corticoides , incluindo Síndrome de Cushing (aumento de cortisol no sangue) e supressão adrenal (diminuição da atividade da glândula adrenal). O médico deve considerar medicamentos alternativos ao propionato de fluticasona, budesonida ou triancinolona injetável, particularmente quando o uso for prolongado;
- Fosamprenavir : a administração conjunta de lopinavir + ritonavir e fosamprenavir diminui a concentração de amprenavir e lopinavir;
- Rifampicina: não deve ser utilizada concomitantemente ao lopinavir + ritonavir por causa da grande redução que ocorre nas concentrações de lopinavir. O uso de rifampicina com o lopinavir + ritonavir pode levar a uma perda da resposta virológica e possivelmente resistência ao lopinavir + ritonavir, à classe dos inibidores de protease ou a outros agentes antirretrovirais coadministrados. Se a coadministração for considerada, o lopinavir + ritonavir deve ser iniciado com doses padronizadas por aproximadamente 10 dias antes da adição da rifampicina. Somente então a dose de lopinavir + ritonavir deve ser titulada. A função hepática deve ser monitorada com atenção;
- Sildenafila: o uso de sildenafila em combinação ao lopinavir + ritonavir é contraindicado em pacientes com hipertensão arterial pulmonar;
- Produtos fitoterápicos: erva de São João ( Hypericum perforatum ) pode reduzir substancialmente a concentração de lopinavir + ritonavir. Portanto, esta combinação é contraindicada;
- Voriconazol : a combinação do lopinavir + ritonavir e voriconazol deve ser evitada, a não ser que o risco-benefício justifique o uso de voriconazol.
Medicamentos com recomendação de alteração ou monitoramento da dose
- Agentes antigotosos: é esperado um aumento nas concentrações de colchicina quando coadministrado com o lopinavir + ritonavir. Interações medicamentosas fatais e de risco à vida têm sido reportadas em pacientes tratados com colchicina e ritonavir. Remeter à bula de colchicina para informações de prescrição;
- Agentes anticancerígenos ( dasatinibe , nilotinibe , venetoclax , vincristina e vimblastina): podem ter suas concentrações aumentadas quando administrados juntamente ao lopinavir + ritonavir, resultando em aumento dos eventos adversos associados a estes agentes anticancerígenos. A coadministração de venetoclax e lopinavir/ritonavir poderia aumentar potencialmente a exposição à venetoclax, resultando em um sério risco de Síndrome da Lise Tumoral. Para venetoclax, nilotinibe e dasatinibe, consultar suas informações de prescrição para instruções de dose;
- Agentes vasodilatadores: a coadministração de bosentana e lopinavir + ritonavir aumenta a concentração de bosentana no sangue. Remeter à bula de bosentana para informações de prescrição;
- Amprenavir: espera-se que o lopinavir + ritonavir aumente as concentrações no sangue de amprenavir. A administração em combinação de lopinavir + ritonavir e amprenavir resulta em redução nas concentrações de lopinavir no sangue. Pode ser necessário um aumento de dose de lopinavir + ritonavir durante a coadministração de amprenavir, particularmente em pacientes com larga experiência de uso de inibidores de protease ou com evidências de perda significante de sensibilidade para o lopinavir. O lopinavir + ritonavir não deve ser administrado uma única vez ao dia em combinação com amprenavir;
- Antiarrítmicos: as concentrações de amiodarona , bepridila, dronedarona , lidocaína e quinidina podem ser aumentadas quando administradas juntamente ao lopinavir + ritonavir. Recomenda-se cuidado;
- Digoxina : a coadministração de ritonavir e digoxina resulta em um aumento significativo dos níveis de digoxina;
Atenção especial deve ser dada quando houver administração combinada destas substâncias, com monitoramento dos níveis sanguíneos de digoxina. - Anticonvulsivantes: carbamazepina, fenobarbital e fenitoína podem reduzir as concentrações de lopinavir. O lopinavir + ritonavir não deve ser administrado uma única vez ao dia em combinação com fenobarbital, fenitoína ou carbamazepina.
A administração combinada de lopinavir + ritonavir e fenitoína pode resultar em diminuição moderada nas concentrações de fenitoína.
Antivirais de ação direta (DAA) para o tratamento da Hepatite C
- Ombitasvir / veruprevir / ritonavir / dasabuvir: as concentrações de ombitasvir, veruprevir e ritonavir podem ser aumentadas quando coadministradas com lopinavir + ritonavir. Portanto, a administração concomitante não é recomendada;
- Simeprevir : o uso concomitante de lopinavir + ritonavir e simeprevir pode resultar em um aumento da concentração de simeprevir no sangue. Não é recomendado coadministrar lopinavir + ritonavir e simeprevir;
- Telaprevir (inibidor da protease do HCV): a coadministração de telaprevir e lopinavir + ritonavir resultou em uma redução da concentração de telaprevir, enquanto lopinavir não foi afetado;
- Atovaquona: pode ocorrer diminuição dos níveis terapêuticos da atovaquona, podendo ser requerida doses maiores desta substância quando da administração concomitante ao lopinavir + ritonavir;
- Claritromicina : para pacientes com insuficiência renal ou hepática (falha no rim ou fígado), deve ser considerada a redução na dose de claritromicina;
- Delamanide: em um estudo de interação medicamentosa com voluntários saudáveis administrou-se delamanide 100 mg duas vezes ao dia e lopinavir + ritonavir 400mg/100mg duas vezes ao dia por 14 dias, as exposições de delamanide e um metabólito delamanide, DM-6705, aumentaram ligeiramente. Caso a coadministração de delamanide com lopinavir/ritonavir for considerada necessária, devido ao risco de prolongamento de QTc associada ao DM-6705, recomenda-se a monitorização frequente por ECG durante todo o período de tratamento com delamanide;
- Nevirapina e efavirenz: a nevirapina pode reduzir os níveis no sangue de lopinavir. Para pacientes que fizeram uso prévio de inibidores de protease ou com perda significante de sensibilidade ao lopinavir, pode ser considerado um aumento de dose do lopinavir + ritonavir quando administrado em combinação à nevirapina ou efavirenz;
O lopinavir + ritonavir não deve ser administrado uma única vez ao dia em combinação com nevirapina ou efavirenz. - Fentanila : é esperado um aumento da concentração plasmática de fentanila quando administrada com o lopinavir + ritonavir. Monitoramento cuidadoso da terapia e eventos adversos (incluindo depressão respiratória) pelo médico são recomendados quando fentanila é administrada concomitantemente com o lopinavir + ritonavir;
- Imunossupressores: as concentrações de ciclosporina , tacrolimo e sirolimo (rapamicina) podem aumentar quando administradas juntamente ao lopinavir + ritonavir. Recomenda-se cautela na coadministração destas drogas;
- Indinavir: espera-se que o lopinavir + ritonavir aumente as concentrações de indinavir. Pode ser necessário diminuir a dose de indinavir durante a administração com o lopinavir + ritonavir;
O lopinavir + ritonavir administrado uma única vez ao dia não foi estudado em combinação com indinavir. - Cetoconazol /itraconazol: o cetoconazol e o itraconazol podem apresentar concentrações sanguíneas aumentadas pelo lopinavir + ritonavir;
- Cetoconazol/itraconazol: o cetoconazol e o itraconazol podem apresentar concentrações sanguíneas aumentadas pelo lopinavir + ritonavir concentração terapêutica do anticonvulsionante pode ser indicado pelo médico, particularmente durante o ajuste de dose;
- Maraviroque (antagonistas de CCR5): a administração concomitante de maraviroque com o lopinavir + ritonavir aumenta os níveis plasmáticos de maraviroque. A dose de maraviroque deve ser diminuída durante a coadministração com o lopinavir + ritonavir. Para mais detalhes, veja as informações de prescrição de maraviroque;
- Metadona : o lopinavir + ritonavir apresentou redução das concentrações plasmáticas da metadona e, por isso, recomenda-se cautela na coadministração destas drogas;
- Nelfinavir: espera-se que o lopinavir + ritonavir aumente as concentrações de nelfinavir e que esta combinação resulte em uma diminuição das concentrações de lopinavir;
O lopinavir + ritonavir não deve ser administrado uma única vez ao dia em combinação com nelfinavir. - Quetiapina: devido à inibição da enzima CYP3A por lopinavir/ritonavir, espera-se um aumento das concentrações de quetiapina. Para instruções de dose de quetiapina, consultar suas informações de prescrição;
- Rifabutina : recomenda-se uma redução da dose da rifabutina quando houver indicação de uso concomitante ao lopinavir + ritonavir. Poderá ser necessária posterior redução da dose de rifabutina;
- Rivaroxabana : a coadministração de rivaroxabana e o lopinavir + ritonavir pode aumentar a exposição de rivaroxabana o que pode aumentar o risco de sangramento;
- Saquinavir: espera-se que o lopinavir + ritonavir aumente as concentrações de saquinavir. Pode ser necessária uma diminuição da dose de saquinavir quando administrado em combinação ao lopinavir + ritonavir;
O lopinavir + ritonavir não deve ser administrado uma única vez ao dia em combinação com saquinavir. - Inibidores de PDE5: recomenda-se cautela no uso de sildenafila, tadalafila e vardenafila para o tratamento de disfunção erétil em pacientes recebendo o lopinavir + ritonavir. É esperado que essa associação aumente substancialmente as concentrações destas substâncias no sangue, o que pode levar ao aumento de reações adversas, como hipotensão (pressão baixa) e ereção persistente;
- Avanafil: a coadministração de lopinavir + ritonavir com avanafil pode resultar em um grande aumento na exposição à avanafil, logo, essa coadministração não é recomendada;
- Sildenafila: a sildenafila, para tratamento da disfunção erétil, deve ser utilizada com cautela, em doses reduzidas de 25 mg a cada 48 horas com monitoramento dos eventos adversos;
- Tadalafila: use tadalafila com atenção em doses reduzidas de no máximo 10 mg a cada 72 horas com monitoramento intensivo dos eventos adversos. Quando tadalafila é administrada para o tratamento de hipertensão arterial pulmonar em pacientes recebendo o lopinavir + ritonavir, remeter à bula de tadalafila para informações de prescrição;
- Vardenafila: use vardenafila com atenção em doses reduzidas de no máximo 2,5 mg a cada 72 horas com monitoramento intensivo dos efeitos adversos;
- Tenofovir: um estudo mostrou que o lopinavir + ritonavir aumenta a concentração de tenofovir. Pacientes utilizando esta combinação devem ser monitorados em relação aos eventos adversos associados ao tenofovir;
- Trazodona: o uso concomitante de ritonavir e trazodona pode aumentar a concentração de trazodona. Eventos adversos como náuseas, vertigens, hipotensão (pressão baixa) e desmaio foram observados. A combinação deve ser usada com atenção e uma dose menor de trazodona pode ser considerada;
- Varfarina : a concentração de varfarina pode ser afetada quando administrada em combinação o lopinavir + ritonavir.
Recomenda-se cautela na coadministração destas drogas.
Outras Interações Medicamentosas
- Bupropiona: a administração conjunta de lopinavir + ritonavir e bupropiona diminui a concentração sanguínea da bupropiona;
- Delavirdina: a delavirdina tem o potencial de aumentar as concentrações plasmáticas de lopinavir;
- Bloqueadores de canal de cálcio: derivados da diidropiridina (felodipina, nifedipina , nicardipina) podem ter as suas concentrações aumentadas quando administrados juntamente ao lopinavir + ritonavir;
- Dexametasona : pode reduzir as concentrações de lopinavir;
- Ritonavir: quando o lopinavir + ritonavir foi coadministrado a mais 100 mg de ritonavir duas vezes ao dia, os níveis de lopinavir aumentaram no sangue;
- Etravirina : o uso concomitante de lopinavir + ritonavir com etravirina causa uma diminuição na concentração de etravirina no sangue, porém, não é necessário ajuste de dose pelo médico. Remeter à bula de etravirina para informações de prescrição;
- Rilpivirina: o uso concomitante de lopinavir + ritonavir com rilpivirina causa um aumento na concentração de rilpivirina no sangue, porém, não é necessário ajuste de dose pelo médico. Remeter à bula de rilpivirina para informações de prescrição;
- Inibidores Nucleosídicos da Transcriptase Reversa (ITRNs): aumento dos níveis séricos de creatina fosfoquinase (CPK) no sangue (exame laboratorial), dor muscular, inflamação muscular e raramente rabdomiólise (destruição muscular) foram relatados com inibidores de protease, particularmente em combinação com ITRNs;
- Zidovudina e abacavir : o lopinavir + ritonavir apresenta potencial para reduzir as concentrações sanguíneas de zidovudina e abacavir;
- Didanosina: é recomendado que a didanosina seja administrada com estômago vazio, portanto, a didanosina pode ser administrada com o lopinavir + ritonavir comprimidos revestidos sem alimentos.
Interação Medicamentosa com significado clínico não esperado
Estudos de interações medicamentosas revelaram que não há interação clinicamente significativa com o lopinavir + ritonavir e desipramina, omeprazol ou ranitidina.
Estudos não demonstraram interação clinicamente significante entre o lopinavir + ritonavir e raltegravir .
Não são esperadas interações medicamentosas significativas entre o lopinavir + ritonavir e fluvastatina, dapsona , trimetoprima/sulfametoxazol, azitromicina ou fluconazol em pacientes com funções normais de rim e fígado.
Para qualquer interação com outros medicamentos mencionada nesta bula, alterações na dose recomendada de lopinavir + ritonavir somente deverão ser efetuadas pelo médico.
- Estavudina e lamivudina : nenhuma alteração na farmacocinética do lopinavir foi observada quando o lopinavir + ritonavir foi administrado isoladamente ou em combinação com estavudina ou lamivudina;
- Fármacos redutores de acidez gástrica: o lopinavir + ritonavir pode ser utilizado em combinação com fármacos redutores de acidez gástrica (omeprazol e ranitidina) sem a necessidade de ajuste de dose.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para sua saúde.
Qual a ação da substância do Lopinavir + Ritonavir Cristália (Lopinavir + Ritonavir)?
Resultados de Eficácia
Pacientes Sem Terapia Antirretroviral Prévia
Estudo M98-863: Lopinavir + Ritonavir cápsulas duas vezes ao dia + estavudina + lamivudina em comparação a nelfinavir três vezes ao dia + Estavudina + Lamivudina
O Estudo M98-863 foi um ensaio randomizado, duplo-cego, multicêntrico, comparando o tratamento com Lopinavir + Ritonavir cápsulas (400/100 mg duas vezes ao dia) mais estavudina e lamivudina versus nelfinavir (750 mg três vezes ao dia) mais estavudina e lamivudina em 653 pacientes sem tratamento antirretroviral prévio (naive).
Os pacientes tinham uma média de idade de 38 anos (faixa: 19 a 84), 57% eram caucasianos e 80% eram do sexo masculino. A contagem celular média basal de CD4 foi de 259 células/mm³ (faixa: 2 a 949 células/mm³) e a concentração plasmática basal média de RNA HIV-1 foi de 4,9 log 10 cópias/mL (faixa: 2,6 a 6,8 log 10 cópias/mL).
A resposta ao tratamento e os resultados do tratamento randomizado estão presentes na figura a seguir e na tabela a seguir, respectivamente:

* Proporção de pacientes que, a cada momento na escala de tempo, atingiram e mantiveram uma concentração plasmática de RNA do HIV <400 cópias/mL, e que estão sob sua medição original do estudo e que não experimentaram um novo evento CDC Classe C.
** BID - Bis in die ou duas vezes ao dia.
| Resultados do Tratamento Randomizado até a Semana 48 (Estudo 863) | ||
| Resultado | Lopinavir + Ritonavir + d4T + 3TC (N=326) | Nelfinavir + d4T + 3TC (N=327) |
| Respondedores* 1 | 75% | 62% |
| Falha virológica 2 | 9% | 25% |
| Rebote 2 | 7% | 15% |
| Nunca suprimiu até a Semana 48 2 | 2% | 9% |
| Morte | 2% | 1% |
| Descontinuou por evento adverso | 4% | 4% |
| Descontinuou por outras razões 3 | 10% | 8% |
* Corresponde às taxas na Semana 48 da Figura acima.
1 Pacientes atingiram e mantiveram RNA HIV confirmado de <400 cópias/mL até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <400 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Descontinuação global até a Semana 48, incluindo pacientes que descontinuaram após a ocorrência de falha virológica, foi de 17% no grupo com Lopinavir + Ritonavir e de 24% no grupo com Nelfinavir.
Ao longo de 48 semanas de tratamento, houve uma proporção estatística e significativamente maior de pacientes no braço com Lopinavir + Ritonavir , em comparação ao braço com Nelfinavir, que apresentaram níveis plasmáticos de RNA HIV menores que 400 cópias/mL (75% versus 62%, respectivamente) e RNA HIV <50 cópias/mL (67% versus 52%, respectivamente).
A resposta ao tratamento pelos subgrupos de nível basal de RNA HIV é apresentada na tabela a seguir:

2 Pacientes atingiram RNA HIV <50 cópias/mL até a Semana 48.
Ao longo de 48 semanas de tratamento, o aumento médio desde a linha basal na contagem de células CD 4 foi de 207 células/mm³ para o braço com Lopinavir + Ritonavir e de 195 células/mm³ para o braço com Nelfinavir.
A Figura a seguir exibe as estimativas de Kaplan-Meier do tempo para a falha de tratamento no Estudo 863. O tempo até a falha de tratamento foi definido como o menor tempo para que o paciente experimentasse falha virológica (2 valores consecutivos de RNA HIV demonstrando rebote, acima de 400 cópias/mL), um novo evento CDC de Classe C ou descontinuação prematura do estudo.
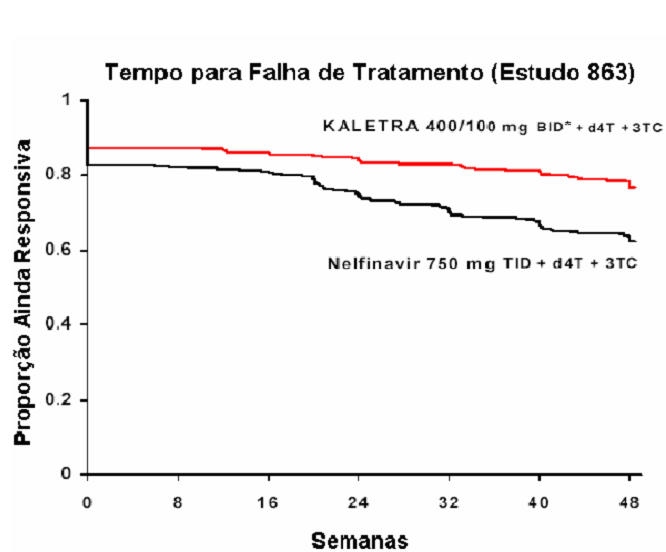
* BID - Bis in die ou duas vezes ao dia.
Estudo M97-720: Lopinavir + Ritonavir cápsulas duas vezes ao dia + Estavudina + Lamivudina
O Estudo M97-720 foi um ensaio randomizado, cego e multicêntrico avaliando o tratamento com Lopinavir + Ritonavir cápsulas em três diferentes doses (Grupo I: 200/100 mg duas vezes ao dia e 400/100 mg duas vezes ao dia; Grupo II: 400/100 mg duas vezes ao dia e 400/200 mg duas vezes ao dia) mais Lamivudina (150 mg duas vezes ao dia) e Estavudina (40 mg duas vezes ao dia), em 100 pacientes.
Todos os pacientes foram convertidos a Lopinavir + Ritonavir para o estudo de forma aberta na concentração de 400/100 mg duas vezes ao dia entre as Semanas 48 e 72 do estudo. Os pacientes tinham uma média de idade de 35 anos (faixa: 21 a 59), 70% eram caucasianos e 96% eram do sexo masculino.
A contagem celular média basal de CD4 era de 338 células/mm³ (faixa: 3 a 918 células/mm³) e o nível plasmático médio basal de RNA HIV-1 era de 4,9 log 10 cópias/mL (faixa: 3,3 a 6,3 log 10 cópias/mL).
Ao longo das 360 semanas de tratamento no Estudo 720, a proporção de pacientes com RNA HIV < 400 cópias/mL (< 50 cópias/mL) foi de 61% (59%) [n=100] e o aumento médio correspondente na contagem de células CD4 foi de 501 células/mm³. Trinta e nove pacientes (39%) descontinuaram o estudo, incluindo 15 (15%) descontinuações por eventos adversos e uma (1%) morte.
Dezoito pacientes demonstraram perda da resposta virológica (2 valores plasmáticos consecutivos para o RNA HIV-1 acima de 400 cópias/mL, um valor de rebote do RNA do HIV-1 seguido por descontinuação, ou falha em atingir o RNA HIV-1 <400 cópias/mL).
Análise genotípica de isolados virais foi conduzida nestes pacientes e em 10 pacientes adicionais com valores de RNA HIV-1 isolados > 400 cópias/ml após a semana 24. Os resultados de 19 pacientes não mostraram mutações primárias ou ativas na protease ( aminoácidos nas posições 8, 30, 32, 36, 47, 48, 50, 82, 84 e 90) ou resistência fenotípica a inibidor de protease.
Estudo M05-730: Lopinavir + Ritonavir comprimidos uma vez a dia + Tenofovir DF + emtricitabina comparado com Lopinavir + Ritonavir duas vezes ao dia + Tenofovir DF + entricitabina
O Estudo M05-730 foi um ensaio randomizado, aberto e multicêntrico comparando o tratamento de Lopinavir + Ritonavir 800/200 mg uma vez ao dia com tenofovir DF e Emtricitabina com Lopinavir + Ritonavir 400/100 mg duas vezes ao dia mais tenofovir DF e entricitabina em 664 pacientes sem tratamento antirretroviral prévio (naive).
Os pacientes foram randomizados na razão 1:1 para receber Lopinavir + Ritonavir 800/200mg uma vez ao dia (n=333) ou Lopinavir + Ritonavir 400/100 mg duas vezes ao dia (n=331).
Uma estratificação adicional foi feita em cada grupo na proporção 1:1 (comprimidos versus cápsulas). Os pacientes que receberam cápsulas foram transferidos para a formulação comprimidos na oitava semana e mantidos na posologia da randomização. Os pacientes receberam 200 mg de emtricitabina e 300 mg de tenofovir DF uma vez ao dia. A média de idade dos pacientes foi de 39 anos (faixa: 19 a 71 anos); 75% eram caucasianos e 78% do sexo masculino.
A contagem celular média basal de CD4 era de 216 células/mm³ (faixa: 20 a 775 células/mm³) e o nível plasmático médio basal de RNA HIV-1 era de 5,0 log10 cópias/mL (faixa: 1,7 a 7,0 log10 cópias/mL).
A resposta ao tratamento e os resultados do tratamento randomizado na semana 48 estão presentes na tabela a seguir:
| Resultados do Tratamento Randomizado até a Semana 48 (Estudo 730) | ||
| Resultado | Lopinavir + Ritonavir uma vez ao dia + TDF + FTC (N=333) | Lopinavir + Ritonavir duas vezes ao dia + TDF + FTC (N=331) |
| Respondedores 1 | 78% | 77% |
| Falha virológica 2 | 10% | 8% |
| Rebote 2 | 5% | 5% |
| Nunca suprimiu até a Semana 48 2 | 5% | 3% |
| Morte | 1% | < 1% |
| Descontinuou por evento adverso | 4% | 3% |
| Descontinuou por outras razões 3 | 8% | 11% |
1 Pacientes atingiram e mantiveram RNA HIV-1 confirmado de <50 cópias/mL até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <50 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Até a Semana 48 de terapia, 78% dos pacientes do braço de Lopinavir + Ritonavir uma vez ao dia e 77% do braço Lopinavir + Ritonavir duas vezes ao dia atingiram e mantiveram RNA HIV-1 <50 cópias/mL (95% do intervalo de confiança e diferença de 5,9% para 6,8%).
A contagem celular média de CD4 aumentou na Semana 48 foi de 186 células/mm³ no braço Lopinavir + Ritonavir uma vez ao dia e 198 células/mm³ no braço Lopinavir + Ritonavir duas vezes ao dia.
Pacientes com Tratamento Antirretroviral Prévio
Atividade Antiviral de Lopinavir + Ritonavir em Pacientes com Terapia Prévia com Inibidor de Protease
A relevância clínica da sensibilidade reduzida in vitro a lopinavir foi examinada pela avaliação da resposta virológica à terapia com Lopinavir + Ritonavir com relação ao genótipo e fenótipo viral basal, em 56 pacientes naive para NNRTI* com RNA HIV superior a 1.000 cópias/mL, a despeito de terapia prévia com pelo menos 2 inibidores de protease, selecionados entre Nelfinavir, Indinavir, Saquinavir e Ritonavir (Estudo M98-957).
Nesse estudo, os pacientes foram inicialmente randomizados para receber uma de duas doses de Lopinavir + Ritonavir , em combinação com efavirenz e inibidores nucleosídeos da transcriptase reversa.
*NNRTI = Non-Nucleoside Reverse Transcriptase Inhibitor ou Inibidor Não-nucleosídeo da Transcriptase Reversa.
Os valores para a EC50 de lopinavir contra os 56 isolados virais basais, variaram de números entre 0,5 a 96 vezes mais elevados que a EC50 contra o tipo selvagem de HIV. Cinquenta e cinco por cento (31/56) destes isolados basais exibiram uma sensibilidade a lopinavir reduzida mais que 4 vezes. Estes 31 isolados tiveram uma redução média na sensibilidade a lopinavir de 27,9 vezes.
Após 48 semanas de tratamento com Lopinavir + Ritonavir , efavirenz e inibidores nucleosídeos da transcriptase reversa, um valor plasmático para o RNA HIV menor que, ou igual a, 400 cópias/mL, foi observado em 93% (25/27), 73% (11/15) e 25% (2/8) dos pacientes com sensibilidade a lopinavir reduzida, menos que ou igual a 10 vezes; mais que 10 e menos que 40 vezes e mais que, ou igual a, 40 vezes àquela da linha basal, respectivamente.
A sensibilidade ao lopinavir foi determinada pela tecnologia de fenotipagem recombinante desenvolvida pela Virologic; o genótipo também foi determinado pela Virologic. Um valor plasmático para o RNA HIV menor que, ou igual, a 50 cópias/mL, foi observado em 81% (22/27), 60% (9/15) e 25% (2/8) nos grupos de pacientes acima, respectivamente.
Há dados insuficientes neste momento para identificar os padrões de mutação associados ao lopinavir nos isolados provenientes de pacientes sob tratamento com Lopinavir + Ritonavir. Outros estudos são necessários para avaliar a associação entre padrões mutacionais específicos e taxas de resposta virológica.
Estudo M98-888: Lopinvair + Ritonavir Lopinavir + Ritonavir cápsulas duas vezes ao dia + Nevirapina + ITRNs em comparação a outros inibidores de protease selecionados pelo Investigador + Nevirapina + ITRNs
O Estudo 888 foi um ensaio randomizado, aberto, multicêntrico comparando o tratamento com Lopinavir + Ritonavir cápsulas (400/100 mg duas vezes ao dia) + Nevirapina e inibidores nucleosídeos da transcriptase reversa versus outros inibidores de protease selecionados pelo Investigador + Nevirapina e inibidores nucleosídeos da transcriptase reversa, em 288 pacientes que já haviam recebido esquema com inibidor de protease único e que nunca haviam recebido inibidores não-nucleosídeos da transcriptase reversa (NNRTI).
Os pacientes tinham uma média de idade de 40 anos (faixa: 18 a 74), 68% eram caucasianos e 86% eram do sexo masculino.
A contagem celular basal média de CD4 foi de 322 células/mm³ (faixa: 10 a 1.059 células/mm³) e o nível plasmático médio de RNA HIV-1 à linha basal era de 4,1 log10 cópias/mL (faixa: 2,6 a 6,0 log10 cópias/mL).
A resposta ao tratamento e os resultados dos tratamentos randomizados até a Semana 48 são apresentados na figura e na tabela a seguir, respectivamente:

* Ensaio AMPLICOR HIV-1 MONITOR, da Roche.
† Responsivos a cada visita, são os pacientes que habiam atingido e mantido uma concentração de RNA do HIV -1 <400 cópias/ML sem descontinuação naquela visita.
| Resultados do Tratamento Randomizado até a Semana 48 (Estudo 888) | ||
| Resultado | Lopinavir + Ritonavir + Nevirapina+ ITRNs (N=148) | Inibidor(es) de protease selecionado(s) pelo Investigador + Nevirapina+ ITRNs (N=140) |
| Respondedores *1 | 57% | 33% |
| Falha virológica 2 | 24% | 41% |
| Rebote 2 | 11% | 19% |
| Nunca suprimiu até a Semana 48 2 | 13% | 23% |
| Morte | 1% | 2% |
| Descontinuou por evento adverso | 5% | 11% |
| Descontinuou por outras razões 3 | 14% | 13% |
* Corresponde às taxas na Semana 48 da Figura acima.
1 Pacientes atingiram e mantiveram RNA HIV confirmado de <400 cópias/mL, até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <400 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Estudo M97-765: Lopinavir + Ritonavir cápsulas duas vezes ao dia + Nevirapina + NRTIs
O Estudo M97-765 foi um ensaio randomizado, cego, multicêntrico, avaliando tratamento com Lopinavir + Ritonavir cápsulas em 2 níveis de dose (400/100 mg duas vezes ao dia e 400/200 mg duas vezes ao dia) mais Nevirapina(200 mg duas vezes ao dia) e 2 NRTIs em 70 pacientes que já haviam recebido esquema com inibidor de protease único, que nunca haviam recebido inibidores não-nucleosídeos de transcriptase reversa (NNRTI).
Os pacientes tinham uma média de idade de 40 anos (faixa: 22 a 66 anos), 73% eram caucasianos e 90% do sexo masculino. A contagem celular média basal de CD4 era 372 células/mm³ (faixa: 72 a 807 células/mm³) e a concentração plasmática basal média de RNA do HIV-1 era de 4,0 log 10 cópias/mL (faixa: 2,9 a 5,8 log 10 cópias/mL).
Ao longo de 144 semanas de tratamento no Estudo 765, a proporção de pacientes com RNA HIV <400 (<50) cópias/mL foi de 54% (50%) [n=70] e o correspondente aumento médio na contagem de células CD4 foi de 212 células/mm³. 27 pacientes (39%) descontinuaram o estudo, incluindo 9 (13%) descontinuações secundárias a eventos adversos e 2 (3%) óbitos.
Estudo M06-802 Lopinavir + Ritonavir comprimidos 800/200 mg uma vez ao dia versus Lopinavir + Ritonavir comprimidos 400/100 mg duas vezes ao dia e coadministrados com inibidores da Transcriptase Reversa Análogos de Nucleosídeo/Nucleotídeo em pacientes infectados pelo HIV-1 com experiência aos antirretrovirais
O estudo M06-802 foi um ensaio randomizado, aberto, comparando-se a segurança, tolerabilidade e atividade antirretroviral de Lopinavir + Ritonavir uma vez ao dia e duas vezes ao dia em 599 pacientes com carga viral detectável enquanto recebiam a terapia antirretroviral.
Os pacientes foram randomizados na razão 1:1 para receber Lopinavir + Ritonavir 800/200mg uma vez ao dia (n=300) ou Lopinavir + Ritonavir 400/100 mg duas vezes ao dia (n=299).
Os pacientes recebiam, pelo menos, dois inibidores da transcriptase reversa análogos de nucleosídeos/nucleotídeos selecionados pelo investigador. A média de idade dos pacientes foi de 41 anos (faixa: 21 a 73 anos); 51% eram caucasianos e 66% do sexo masculino.
A contagem celular média basal de CD4 era de 254 células/mm³ (faixa: 4 a 952 células/mm³) e o nível plasmático médio basal de RNA HIV-1 era de 4,3 log 10 cópias/mL (faixa: 1,7 a 6,6 log 10 cópias/mL).
A resposta ao tratamento e os resultados dos tratamentos randomizados até a Semana 48 são apresentados na tabela a seguir:
| Resultados do Tratamento Randomizado até a Semana 48 (Estudo 802) | ||
| Resultado | Lopinavir + Ritonavir uma vez ao dia + ITRNs | Lopinavir + Ritonavir duas vezes ao dia + ITRNs |
| Respondedores *1 | 55% | 52% |
| Falha virológica 2 | 25% | 28% |
| Rebote 2 | 12% | 14% |
| Nunca suprimiu até a Semana 48 2 | 13% | 14% |
| Morte | 1% | 1% |
| Descontinuou por evento adverso | 4% | 6% |
| Descontinuou por outras razões 3 | 15% | 14% |
1 Pacientes atingiram e mantiveram RNA HIV-1 confirmado de <50 cópias/mL até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <50 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Uso Pediátrico
Estudo M98-9405: Um estudo aberto de fase I/II de ABT-378/ritonavir em combinação com inibidores de transcriptase reversa em pacientes pediátricos infectados com HIV
O Estudo M98-940 foi um ensaio aberto e multicêntrico avaliando o perfil farmacocinético, tolerabilidade, segurança e eficácia de Lopinavir + Ritonavir solução oral contendo lopinavir 80 mg/mL e ritonavir 20 mg/mL, em 100 pacientes pediátricos naive (44%) e que já haviam sido tratados (56%) com algum antirretroviral. Todos os pacientes eram naive para inibidor não-nucleosídeo da transcriptase reversa.
Os pacientes foram randomizados ou para 230 mg lopinavir/57,5 mg Ritonavir por m² ou para 300 mg lopinavir/75 mg Ritonavir por m². Os pacientes naive também receberam Lamivudina e Estavudina. Os pacientes que já haviam sido tratados receberam Nevirapinae até 2 inibidores nucleosídeos da transcriptase reversa.
A segurança, eficácia e perfis farmacocinéticos dos 2 regimes posológicos foram avaliados após 3 semanas de tratamento em cada paciente. Após a análise destes dados, todos os pacientes continuaram sob uma dose de 300 mg de lopinavir/75 mg de ritonavir por m².
Os pacientes tinham uma média de idade de 05 anos (faixa: 06 meses a 12 anos) com 14% deles sendo menores que 02 anos de idade. A contagem celular basal média de CD4 era de 838 células/mm³ e a concentração plasmática média basal de RNA HIV-1 era de 4,7 log 10 cópias/mL.
Ao longo das 48 semanas de tratamento, a proporção de pacientes que atingiu e manteve uma concentração plasmática de RNA HIV <400 cópias/mL foi de 80% entre os pacientes naive para antirretrovirais e de 71% entre os pacientes experientes com antirretrovirais.
O aumento médio desde a linha basal na contagem celular de CD4 foi de 404 células/mm³ para os pacientes naive para antirretrovirais e de 284 células/mm³ para os pacientes experimentados, ao longo da 48 semanas.
Descontinuações prematuras foram notadas em 2 (2%) indivíduos antes da Semana 48. Uma destas foi considerada pelo Investigador como “não-relacionada” ao fármaco do estudo, a segunda como “possivelmente” relacionada ao fármaco do estudo.
A seleção de dose para pacientes com 06 meses a 12 anos de idade baseou-se nos resultados a seguir. O regime com 230/57,5 mg/m² duas vezes ao dia sem Nevirapinae o regime com 300/75 mg/m² duas vezes ao dia com Nevirapinaforneceram concentrações plasmáticas de lopinavir similares àquelas obtidas em pacientes adultos recebendo o regime de 400/100 mg duas vezes ao dia (sem nevirapina).
KONCERT/PENTA 18: Estudo randomizado de farmacocinética, segurança e eficácia do uso de Lopinavir + Ritonavir comprimidos duas vezes por dia versus uma vez por dia doseados por peso como parte da combinação da terapia antirretroviral em pacientes pediátricos/crianças, da rede européia. infectados pelo HIV-1 para o tratamento da AIDS
KONCERT/PENTA 18 é um estudo multicêntrico prospectivo, randomizado e aberto que avaliou o perfil farmacocinético, de eficácia e de segurança de dosagem duas vezes por dia versus uma vez por dia de Lopinavir + Ritonavir comprimidos 100/25 mg dosados por peso como parte da terapia antiretroviral combinada (cART) em crianças infectadas com HIV-1 virologicamente suprimidas (n = 173).
As crianças foram elegíveis quando elas tinham idade < 18 anos, ≥ 15 kg de peso, recebendo cART que incluia Lopinavir + Ritonavir , ácido ribonucleico (RNA) de HIV-1 < 50 cópias/mL por pelo menos 24 semanas e capazes de engolir comprimidos.
Na semana 24, a eficácia e segurança com a dosagem de 2 vezes por dia (n=87) na população pediátrica que recebeu Lopinavir + Ritonavir comprimidos 100/25 mg foi consistente com os estudos de eficácia e a segurança em estudos pediátricos e em adultos anteriores, usando Lopinavir + Ritonavir duas vezes por dia.
Características Farmacológicas
Geral
Lopinavir + Ritonavir é uma formulação combinada de lopinavir e ritonavir. O Lopinavir é um inibidor das proteases do HIV-1 e do HIV-2.
O Ritonavir presente na formulação de Lopinavir + Ritonavir inibe o metabolismo mediado pelo CYP3A (citocromo P450 3A) do lopinavir, proporcionando, deste modo, níveis plasmáticos maiores de lopinavir.
Farmacodinâmica
Mecanismo de ação:
Lopinavir é um inibidor das proteases do HIV-1 e HIV-2. A inibição da protease previne a clivagem da poliproteína gag-pol levando à formação de um vírus imaturo, não infeccioso.
O tempo de início de ação não é aplicável para Lopinavir + Ritonavir uma vez que este medicamento é administrado cronicamente. Com uma dose de 400/100 mg, duas vezes ao dia, as concentrações mínimas de lopinavir são superiores a EC50 do vírus de tipo selvagem (0,07 mcg / mL) por um fator maior que 50, sugerindo que as concentrações de lopinavir são mantidas para a eficácia em todo o intervalo de doses.
Atividade antiviral in vitro :
A atividade antiviral de lopinavir foi avaliada in vitro contra cepas laboratoriais e clínicas do HIV em linhagens de células linfoblásticas e isolados clínicos do HIV em linfócitos periféricos de sangue, infectados agudamente.
Na ausência do soro humano, a CE50 (concentração eficaz 50%) de lopinavir contra cinco cepas laboratoriais diferentes de HIV-1 variou de 10 a 27 nM (0,006 a 0,017 mcg/mL, 1 mcg/mL equivalente a 1,6 μM) e variou de 4 a 11 nM (0,003 a 0,007 mcg/mL) contra vários isolados clínicos de HIV-1 (n=6).
Na presença de 50% de soro humano, a CE50 do Lopinavir contra essas 5 cepas laboratoriais variou de 65 a 289 nM (0,04 a 0,18 mcg/mL), representando uma atenuação de 7 a 11 vezes. Estudos sobre a atividade da combinação de substâncias com Lopinavir e outros inibidores de proteases ou inibidores da transcriptase reversa não foram completados.
Resistência:
Isolados de HIV-1 com sensibilidade reduzida ao Lopinavir foram selecionados in vitro . A presença do ritonavir não parece influenciar a seleção de vírus resistentes ao lopinavir in vitro .
Ainda não foi caracterizada a seleção de resistência ao Lopinavir + Ritonavir no tratamento antirretroviral em pacientes que nunca receberam antirretrovirais. Em um estudo de fase III envolvendo 653 pacientes que nunca haviam recebido tratamento antirretroviral (Estudo 863), foram analisados os isolados virais plasmáticos de cada paciente em tratamento que apresentou HIV plasmático maior do que 400 cópias/mL nas semanas 24, 32, 40 e/ou 48.
Nenhuma evidência de resistência genotípica ou fenotípica a Lopinavir + Ritonavir foi observada em 37 pacientes avaliáveis tratados com Lopinavir + Ritonavir (0%).
Evidência de resistência genotípica a nelfinavir, definida como a presença de mutação D30N e/ou L90M na protease do HIV, foi observada em 25/76 (33%) dos pacientes avaliáveis tratados com nelfinavir. A seleção de resistência a Lopinavir + Ritonavir em pacientes pediátricos que nunca haviam recebido tratamento antirretroviral (Estudo 940), parece ser consistente com aquela vista em pacientes adultos (Estudo 863).
Resistência ao Lopinavir + Ritonavir foi observada em pacientes que fizeram uso prévio de outros inibidores de protease antes da terapia com Lopinavir + Ritonavir.
Em estudos de Fase II com 227 pacientes que nunca haviam recebido tratamento com antirretroviral e multiexperimentados com inibidores de protease, 4 de 23 pacientes com carga viral maior que 400 cópias/mL após tratamento com Lopinavir + Ritonavir por 12 a 100 semanas, mostraram sensibilidade significativamente reduzida ao lopinavir em comparação aos correspondentes isolados virais basais.
Três desses pacientes haviam recebido previamente tratamento com um único inibidor de protease (Nelfinavir, Indinavir ou Saquinavir) e um paciente havia recebido tratamento com múltiplos inibidores de proteases (indinavir, saquinavir, ritonavir).
Os quatro pacientes apresentavam pelo menos 4 mutações associadas à resistência ao inibidor de protease imediatamente antes do tratamento com Lopinavir + Ritonavir.
Depois da replicação viral, todos os isolados desses pacientes continham mutações adicionais, algumas das quais são sabidamente associadas à resistência a inibidores de protease. Entretanto, os dados são insuficientes até o momento para identificar padrões de mutação associada ao lopinavir em isolados de pacientes em tratamento com Lopinavir + Ritonavir. A avaliação desses padrões de mutação está em estudo.
Resistência cruzada:
Estudos pré-clínicos:
Entre os inibidores de proteases foram observados vários graus de resistência cruzada. Foi determinada a atividade in-vitro do lopinavir contra isolados clínicos de pacientes previamente tratados com um único inibidor de protease.
Isolados que apresentaram sensibilidade reduzida acima de 4 vezes, ao nelfinavir (n=13) e saquinavir (n=4), apresentaram sensibilidade reduzida abaixo de 4 vezes ao lopinavir.
Isolados com sensibilidade reduzida acima de 4 vezes ao indinavir (n=16) e ritonavir (n=3) apresentaram a média de redução de sensibilidade de 5,7 e 8,3 vezes em relação ao lopinavir, respectivamente. Isolados de pacientes previamente tratados com dois ou mais inibidores de protease apresentaram maior redução da sensibilidade ao Lopinavir, conforme descrito no item “Resultados de Eficácia: Atividade antiviral do Lopinavir + Ritonavir em pacientes previamente tratados com inibidores de protease”.
Resistência cruzada durante tratamento com Lopinavir + Ritonavir:
Dispõe-se de pouca informação a respeito da resistência cruzada de vírus selecionados durante o tratamento com Lopinavir + Ritonavir.
Isolados de quatro pacientes tratados previamente com um ou mais inibidores de protease que desenvolveram resistência fenotípica ao Lopinavir durante o tratamento com Lopinavir + Ritonavir , tanto permaneceram com a resistência cruzada ou desenvolveram resistência cruzada ao Ritonavir, Indinavir e Nelfinavir.
Todos os vírus permaneceram completamente sensíveis ou apresentaram sensibilidade modestamente reduzida ao amprenavir (resistência de até 8,5 vezes concomitante a 99 vezes ao lopinavir). Os isolados virais de dois indivíduos sem tratamento prévio ao saquinavir permaneceram completamente sensíveis ao saquinavir.
Correlatos genotípicos de resposta virológica reduzida em pacientes com tratamento antirretroviral prévio iniciando terapia combinada com Lopinavir + Ritonavir:
A resposta virológica a Lopinavir + Ritonavir mostrou-se afetada pela presença de três ou mais das seguintes substituições aminoácidas na protease basal: L10F/I/R/V, K20M/N/R, L24I, L33F, M36I, I47V, G48V, I54L/T/V, V82A/C/F/S/T e I84V.
A tabela abaixo mostra a resposta virológica de 48 semanas (RNA HIV menor que 400 cópias/ mL) de acordo com as mutações da resistência de inibição de protease basal acima mencionadas nos Estudos 888 e 765 e Estudo 957.
Resposta virológica (RNA HIV menor que 400 cópias/ mL) na Semana 48 pela susceptibilidade basal de Lopinavir + Ritonavir e pelo número de substituições de protease associado à resposta a Lopinavir + Ritonavir 1 :

2 43% indinavir, 42% Nelfinavir, 10% ritonavir, 15% saquinavir.
3 41% indinavir, 38% Nelfinavir, 4% ritonavir, 16% saquinavir.
4 86% indinavir, 54% nelfinavir, 80% ritonavir, 70% saquinavir.
Farmacocinética
As propriedades farmacocinéticas do lopinavir coadministrado com ritonavir foram avaliadas em voluntários adultos sadios e em pacientes infectados pelo HIV; e não foram observadas diferenças substanciais entre os 2 grupos. O Lopinavir é completamente metabolizado pelo CYP3A. O Ritonavir inibe o metabolismo do lopinavir, aumentando, deste modo, os níveis plasmáticos de lopinavir.
Nos estudos, a administração de Lopinavir + Ritonavir 400/100 mg, duas vezes ao dia, proporcionou concentrações plasmáticas médias no estado de equilíbrio (steady-state) 15 a 20 vezes maiores do que aquelas com ritonavir, em pacientes infectados pelo HIV.
Os níveis plasmáticos de ritonavir são menos de 7% daqueles obtidos após a administração de 600 mg de ritonavir duas vezes ao dia. A CE50 antiviral do lopinavir in vitro é aproximadamente 10 vezes menor do que a do Ritonavir. Deste modo, a atividade antiviral de Lopinavir + Ritonavir é devida ao Lopinavir.
A Figura a seguir mostra as concentrações plasmáticas médias obtidas no estado de equilíbrio de lopinavir e ritonavir, após Lopinavir + Ritonavir 400/100 mg duas vezes ao dia com alimentação por 3 semanas; dado este proveniente de um estudo farmacocinético em indivíduos adultos infectados com HIV (n=19).
As concentrações plasmáticas de lopinavir e ritonavir após a administração de 2 comprimidos de 200/50 mg, são equivalentes àquelas de 3 cápsulas de 133/33 mg sob condição de não-jejum, com menos variabilidade farmacocinética.

Absorção:
Em um estudo de farmacocinética com 19 pacientes infectados pelo HIV, a administração múltipla de Lopinavir + Ritonavir 400/100 mg, duas vezes ao dia, com alimentos, durante 3 semanas produziu uma concentração plasmática pico (C máx ) (média ± desvio padrão) de 9,8 ± 3,7 μg/mL, que ocorreu aproximadamente 4 horas após a administração.
A concentração média no estado de equilíbrio antes da dose matinal foi de 7,1 ± 2,9 μg/mL e a C min no intervalo da dose foi de 5,5 ± 2,7 μg/mL. A AUC do lopinavir durante um período de administração de 12 horas foi em média de 92,6 ± 36,7 μg.h/mL.
A biodisponibilidade absoluta de lopinavir em fórmula combinada com ritonavir não foi determinada em humanos. Sob condições pós–prandiais (500 kcal/ 25% proveniente de gordura), as concentrações de lopinavir foram similares na administração de Lopinavir + Ritonavir cápsulas e solução oral.
Na administração de Lopinavir + Ritonavir em jejum, a AUC e a C máx do lopinavir foram 22% menores para o Lopinavir + Ritonavir solução oral em relação às cápsulas.
Efeitos da alimentação sobre a absorção oral:
Lopinavir + Ritonavir cápsulas e solução oral foram bioequivalentes em condições pós-prandiais (refeição com teor moderado de gordura).
A administração de uma dose única de 400/100 mg de Lopinavir + Ritonavir cápsulas com uma refeição com teor moderado de gordura (500-682 Kcal, 23 a 25% de calorias provenientes de gordura) foi associada com um aumento médio de 48% e 23% na AUC e na C máx do lopinavir, respectivamente, em relação ao jejum.
Para Lopinavir + Ritonavir solução oral os aumentos correspondentes na AUC e na C máx de lopinavir foram de 80% e 54%, respectivamente. A administração de Lopinavir + Ritonavir com uma refeição rica em gorduras (872 Kcal, 56% provenientes de gordura) aumentou a AUC e a C máx do lopinavir em 97% e 43%, respectivamente, para as cápsulas e 130% e 56%, respectivamente, para a solução oral.
Para aumentar a biodisponibilidade e minimizar a variabilidade, Lopinavir + Ritonavir deve ser tomado com as refeições.
Distribuição:
No estado de equilíbrio, lopinavir está aproximadamente 98-99% ligado a proteínas plasmáticas. O lopinavir se liga tanto à alfa-1 glicoproteína ácida quanto à albumina, no entanto, tem maior afinidade pela alfa-1 glicoproteína ácida.
No estado de equilíbrio, a ligação de lopinavir a proteínas permanece constante em todas as concentrações observadas após a administração de Lopinavir + Ritonavir , 400/100 mg, duas vezes ao dia, e é similar em voluntários sadios e pacientes HIV- positivos.
Metabolismo:
Experiências in vitro com microssomas hepáticos humanos indicam que lopinavir sofre principalmente metabolismo oxidativo. Lopinavir é extensamente metabolizado pelo sistema citocromo P450 hepático, quase que exclusivamente pela isoenzima CYP3A. O ritonavir é um potente inibidor do CYP3A, inibindo o metabolismo do lopinavir e, deste modo, aumentando os níveis plasmáticos de lopinavir.
Um estudo com Lopinavir marcado com 14C em humanos mostrou que 89% da radioatividade plasmática após uma administração única de Lopinavir + Ritonavir 400/ 100 mg foi decorrente da droga-mãe.
Pelo menos 13 metabólitos oxidativos de lopinavir foram identificados no ser humano. O Ritonavir mostrou induzir enzimas metabólicas, resultando na indução de seu próprio metabolismo. As concentrações de Lopinavir antes da administração diminuem com o tempo com a administração múltipla, estabilizando após cerca de 10 a 16 dias.
Eliminação:
Após uma dose de 400/100 mg de Lopinavir/Ritonavir marcados com 14C, aproximadamente 10,4 ± 2,3% e 82,6 ± 2,5% de uma dose administrada de lopinavir marcado com 14C pode ser encontrado na urina e nas fezes, respectivamente, depois de 8 dias. Lopinavir inalterado correspondeu a aproximadamente 2,2% e 19,8% da dose administrada na urina e fezes, respectivamente. Após múltiplas doses, menos de 3% da dose de lopinavir é excretada inalterada pela urina. A depuração aparente (CL/F) do lopinavir é 5,98 ± 5,75 L/h (média ± desvio padrão, n= 19).
Administração uma vez ao dia:
A farmacocinética de Lopinavir + Ritonavir comprimido administrado uma única vez ao dia foi avaliada em pacientes sem tratamento antirretroviral prévio (naive). Lopinavir + Ritonavir (Lopinavir/Ritonavir) 800mg/200mg foi administrado em combinação com emtricitabina 200mg e tenofovir DF 300mg como parte do esquema posológico de uma vez ao dia.
Múltiplas doses de Lopinavir + Ritonavir comprimido 800mg/200mg uma vez ao dia por 2 semanas sem restrição alimentar (n=16) produziram uma média ± desvio padrão da C max de 14,8 ± 3,5μg/mL, a qual ocorreu aproximadamente 6 horas após a administração. A concentração mínima no estado de equilíbrio de lopinavir antes da administração matinal foi de 5,5 ± 5,4 μg/mL e a concentração mínima dentro do período entre doses foi de 3,2 ± 3,4 μg/mL. A AUC de lopinavir em um intervalo de 24 horas de administração foi em média 206,5 ± 89,7 μg•h/mL.
Efeitos no Eletrocardiograma :
O intervalo QTcF foi avaliado em um estudo controlado cruzado, randomizado, placebo e ativo (moxifloxacina 400 mg/uma vez ao dia), com 39 adultos sadios, com 10 medidas durante 12 horas no Dia 3. A média de diferença máxima (intervalo de confiança superior a 95%) no QTcF do placebo foi de 3,6 (6,3) mseg e 13,1 (15,8) mseg para Lopinavir/Ritonavir 400/100 mg duas vezes ao dia e supraterapêutica de 800/200 mg duas vezes ao dia, respectivamente.
Os dois regimes resultaram em exposições no Dia 3 de, aproximadamente, 1,5 a 3 vezes maior que as observadas com as doses recomendadas nas terapias de dose única diária e duas doses diárias no estado de equilíbrio. Nenhum voluntário teve um aumento na QTcF > 60 mseg da baseline ou um intervalo QTcF que excedesse o limite clinicamente relevante de 500 mseg.
Um discreto prolongamento no intervalo PR também foi verificado em voluntários recebendo Lopinavir/Ritonavir durante o mesmo estudo no Dia 3. O intervalo PR máximo foi de 286 mseg e não houve bloqueio cardíaco de segundo ou terceiro graus em voluntários deste estudo.
Carcinogênese e mutagênese:
Estudos de longo prazo sobre carcinogênese com Lopinavir + Ritonavir em ratos revelaram a indução não-genotóxica, não-mitogênica de tumores hepáticos, geralmente considerados de baixo risco em humanos. Estudos de carcinogênese em ratos não se mostraram tumorigênicos.
O Lopinavir não se mostrou mutagênico ou clastogênico em uma bateria de ensaios in vitro , incluindo o teste de Ames de mutação bacteriana reversa, o teste de linfoma em camundongos e testes de aberração cromossômica em linfócitos humanos. Lopinavir + Ritonavir não foi mutagênico ou clastogênico em testes in vivo com micronúcleos de camundongos.
Como devo armazenar o Lopinavir + Ritonavir Cristália?
O lopinavir + ritonavir comprimido revestido deve ser armazenado em temperatura ambiente (temperatura entre 15 e 30°C) e protegido da umidade.
Prazo de validade
Se armazenado nas condições recomendadas, o medicamento se manterá próprio para consumo pelo prazo de validade de 24 meses, a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
Os comprimidos de lopinavir + ritonavir (200 + 50 mg) apresentam-se como comprimidos revestidos, oblongos, biconvexos, de cor amarelo a amarelo escuro.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Lopinavir + Ritonavir Cristália
Reg. MS Nº 1.0298.0436
Farmacêutico Responsável:
Dr. José Carlos Módolo
CRF-SP n°10.446
Cristália - Produtos Químicos Farmacêuticos Ltda.
Rod. Itapira-Lindóia, km 14 - Itapira - SP
CNPJ: 44.734.671/0001-51
Indústria Brasileira
SAC:
0800 7011918
Venda sob prescrição médica.
Só pode ser vendido com retenção da receita.