Bosentana Zodiac
Bula do Medicamento - Farmacologia do Remédio
Bosentana Zodiac, para o que é indicado e para o que serve?
Bosentana é indicada no tratamento da Hipertensão Arterial Pulmonar (OMS - Grupo I) em pacientes de classe funcional II, III e IV, segundo classificação da Organização Mundial da Saúde (OMS) para melhorar a capacidade física e diminuir a taxa de agravamento clínico.
Bosentana também é indicada para redução do número de novas úlceras nos dedos (úlceras digitais) que geralmente surgem em pessoas com uma doença chamada esclerodermia .
Como o Bosentana Zodiac funciona?
O medicamento bosentana está indicado na Hipertensão Arterial Pulmonar (aumento da pressão sanguínea nos vasos sanguíneos arteriais dos pulmões). Bosentana reduz a pressão arterial, dilatando os vasos sanguíneos arteriais. Bosentana também atua reduzindo o aparecimento de novas úlceras nos dedos (úlceras digitais), que muitas vezes surgem em pessoas com uma doença chamada esclerodermia.
Quais as contraindicações do Bosentana Zodiac?
Você não deve tomar bosentana:
- Se você for alérgico (hipersensível) a bosentana ou a qualquer um dos componentes da fórmula;
- Se você tiver problemas de fígado (esclareça com seu médico);
- Se você estiver tomando ciclosporina A (usado após transplante de órgãos ou tratamento de psoríase );
- Se você estiver grávida;
- Se você for mulher em idade fértil que não usa métodos contraceptivos confiáveis (o uso de contraceptivos hormonais exclusivamente para a contracepção não é eficaz no tratamento com bosentana).
Este medicamento é contraindicado para menores de 3 anos.
Como usar o Bosentana Zodiac?
Você deve tomar os comprimidos com líquido, por via oral.
Os comprimidos devem ser ingeridos com água. A bosentana deve ser tomada pela manhã e à noite, com ou sem alimento. Em pacientes adultos, o tratamento com bosentana deve ser iniciado com dose de 125 mg por dia durante 4 semanas e 2 comprimidos de 125 mg por dia como manutenção.
Para pacientes pediátricos e pacientes com baixo peso corporal considerar a tabela peso corpóreo x dose:
| Peso corpóreo | Dose inicial (4 semanas) | Dose de manutenção |
| 10 ≤ x ≤ 20 | 31,25 mg (1 x dia) | 31,25 mg (2 x dia) |
| 20 < x ≤ 40 | 31,25 mg (2 x dia) | 62,5 mg (2 x dia) |
| > 40 kg | 62,5 mg (2 x dia) | 125 mg (2 x dia) |
Não há dados clínicos em crianças abaixo de 3 anos de idade.
Não interrompa o tratamento sem o conhecimento de seu médico.
O uso inadequado do medicamento pode mascarar ou agravar os sintomas.
Este medicamento não deve ser partido ou mastigado.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
O que devo fazer quando eu me esquecer de usar o Bosentana Zodiac?
Se você se esquecer de tomar bosentana, tome a dose assim que você se lembrar, e em seguida continue a tomar os comprimidos subsequentes segundo a orientação inicial de seu médico. Não tome uma dose dupla para compensar os comprimidos que foram esquecidos.
A interrupção repentina do tratamento com bosentana pode resultar em agravamento dos sintomas. Não pare de tomar bosentana a menos que seu médico tenha solicitado. Seu médico poderá pedir a você para que reduza a dose por alguns dias antes da interrupção completa.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Bosentana Zodiac?
Antes de iniciar o tratamento e a cada mês durante o tratamento com bosentana é necessário que o médico solicite uma análise de sangue para avaliar o funcionamento do fígado e se há presença de anemia . Para as mulheres em idade fértil, deve-se realizar também o teste de gravidez .
Os médicos devem discutir com seus pacientes a importância do monitoramento mensal das transaminases séricas e do teste de gravidez através do sangue ou da urina e, sobre o cuidado de evitar-se a gravidez. Em caso de pacientes do sexo feminino, o médico deverá orientar na escolha de método contraceptivo eficaz para evitar-se a gravidez. Pode-se recorrer à ajuda de ginecologistas.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe ao seu médico ou cirurgião-dentista o aparecimento de reações indesejáveis.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de qualquer outro medicamento, incluindo medicamentos isentos de prescrição. É especialmente importante informar ao seu médico se você estiver tomando:
- Contraceptivos hormonais (uma vez que estes não são eficazes como o único método de contracepção quando você toma bosentana) Seu médico e/ou ginecologista estabelecerá a contracepção adequada para você.
- Glibenclamida (para diabetes ) (uma vez que essa combinação pode aumentar o risco de efeitos colaterais);
- Ciclosporina A (um medicamento utilizado após os transplantes e para tratar a psoríase), ou qualquer outro medicamento utilizado para evitar a rejeição de órgãos transplantados (uma vez que estes medicamentos podem aumentar a concentração de bosentana em seu sangue);
- Fluconazol (para micoses) (uma vez que este medicamento pode aumentar as concentrações de bosentana no sangue);
- Rifampicina (para tuberculose ) (uma vez que esse medicamento pode reduzir a eficácia de bosentana);
- Medicamentos para o tratamento de infecção por HIV .
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
O medicamento deve ser tomado por via oral.
Informe o seu médico se ficar grávida ou pretende engravidar. Você não deve tomar bosentana se estiver grávida e, também não deve engravidar enquanto estiver sendo tratada com bosentana. A possibilidade de que bosentana seja perigoso para o feto não pode ser excluída.
Se você é uma mulher em idade fértil , o seu médico ou ginecologista recomendará métodos contraceptivos seguros durante o tratamento com bosentana. Devido à possibilidade de bosentana inativar anticoncepcionais hormonais (por exemplo, por via oral, injetável, implante ou adesivos), este método contraceptivo por si só não é seguro. Portanto, se você faz uso de contraceptivos hormonais, você também deve utilizar um método contraceptivo de barreira (por exemplo., preservativo feminino, diafragma, esponja contraceptiva ou seu parceiro também deve usar preservativo). Testes de gravidez mensais são recomendados enquanto você estiver tomando bosentana e apresentar potencial para engravidar.
Informe ao seu médico se você estiver amamentando. Você será aconselhada a interromper a amamentação se estiver sendo tratada com bosentana, uma vez que não se sabe se este medicamento passa para o leite materno de mulheres tratadas com bosentana.
Alterações na capacidade de dirigir veículos e operar máquinas
Os efeitos de bosentana sobre a habilidade de dirigir e/ou operar máquinas não foram estudados, porém deve-se levar em consideração que podem ocorrer tonturas com a administração de bosentana.
Quais as reações adversas e os efeitos colaterais do Bosentana Zodiac?
Como todo medicamento, bosentana pode causar reações adversas, apesar de nem todas as pessoas apresentarem.
Se você notar:
- Náusea (desejo de vomitar);
- Vômito ;
- Febre (temperatura elevada);
- Dor no estômago (abdomen);
- Icterícia (amarelamento da pele ou branqueamento de seus olhos);
- Urina de cor escura;
- Coceira na pele;
- Letargia ou fadiga ( cansaço ou exaustão incomum);
- Síndrome gripal (dor nas articulações e dor muscular com febre).
Procure imediatamente seu médico, pois isto pode estar relacionado com alterações da função hepática.
As reações adversas ao medicamento mais frequentemente relatadas (ocorrem em pelo menos 1% dos pacientes tratados com bosentana e com uma frequência de pelo menos 0,5% mais do que com placebo são dor de cabeça (11,5% vs. 9,8%), edema /retenção de líquido (13,2% vs. 10,9%), teste de função hepática (10,9% vs. 4,6%) e anemia/diminuição da hemoglobina (9,9% vs. 4,9%).
Esses efeitos secundários ocorrem em determinadas frequências, que são definidas como segue:
- Muito comum: afetam mais de 1 usuário em 10.
- Comum: afetam 1 a 10 usuários em 100.
- Pouco comum: afetam 1 a 10 usuários em 1.000.
- Raros: afetam 1 a 10 usuários em 10.000.
- Muito raro: afetam menos de 1 usuário em 10.000.
| Freqüência das Reações Adversas | Parâmetros |
| > 1/10 (> 10%) | Muito comum |
| > 1/100 até >1/10 (> 1% até 10%) | Comum (freqüente) |
| > 1/1.000 até <1/100 (> 0,1% até 1%) | Incomum (Infreqüente) |
| > 1/10.000 até <1.000 (> 0,01% até 0,1%) | Raro |
| < 1/10.000 (<0,01%) | Muito raro |
Quando bosentana foi administrada em estudos clínicos, ocorreram as seguintes reações adversas:
Reações adversas muito comuns
- Dor de cabeça;
- Teste de função hepática anormal;
- Edema (inchaço das pernas e dos tornozelos ou outros sinais de retenção de líquido).
Reações adversas comuns
- Anemia (baixo número de células vermelhas do sangue) ou diminuição da hemoglobina;
- Aparência ruborizada;
- Reações de hipersensibilidade (incluindo inflamação da pele, prurido (coceira) e exantema);
- Doença do refluxo gastroesofágico (refluxo ácido);
- Diarreia ;
- Vermelhidão da pele.
As seguintes reações adversas ocorreram durante o uso de bosentana no mercado:
Comuns
- Síncope (desmaio);
- Palpitações (batimentos cardíacos rápidos ou irregulares);
- Baixa pressão arterial;
- Congestão nasal.
Incomuns
- Trombocitopenia (baixa contagem de plaquetas no sangue);
- Neutropenia/leucopenia (baixa contagem de células brancas do sangue);
- Testes de função hepática elevados com hepatite (inflamação do fígado) e/ou icterícia (amarelamento da pele ou branqueamento dos olhos).
Raros
- Anafilaxia (reação alérgica geral), angioedema (inchaço, geralmente ao redor dos olhos, lábios, língua ou garganta);
- Cirrose hepática (scarning), insuficiência hepática (distúrbio sério da função hepática).
Desconhecidos (não pode ser estimada a partir dos dados disponíveis)
- Anemia (número baixo de glóbulos vermelhos) ou diminuição da hemoglobina necessitando transfusão sanguínea.
Caso alguma destas reações adversas torne-se mais grave ou se você notar alguma reação adversa não listada nesta bula ou sinais de reação alérgica (por exemplo: edema inflamatório da face ou língua, exantema, prurido) enquanto estiver tomando bosentana, ou se alguma das reações adversas mencionadas acima lhe dizem respeito, por favor, consulte seu médico.
Informe seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - Notivisa, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.
Qual a composição do Bosentana Zodiac?
Bosentana 125 mg
Cada comprimido revestido contém:
129,082 mg de bosentana monoidratado equivalente a 125,00 mg de bosentana.
Excipientes: croscarmelose sódica, amido pré-gelatinizado, povidona , dióxido de silício coloidal, celulose microcristalina, estearilfumarato de sódio, beenato de glicerila, opadry branco*, óxido de ferro amarelo e óxido de ferro vermelho.
*Composto por polietilenoglicol, hidroxipropilmetilcelulose, polissorbato 80, dióxido de titânio CI 77891.
Apresentação do Bosentana Zodiac
Comprimidos revestidos 125 mg
Embalagem com 60 comprimidos revestidos.
Uso oral.
Uso adulto e pediátrico.
Superdose: o que acontece se tomar uma dose do Bosentana Zodiac maior do que a recomendada?
Se você tomar uma dose muito grande deste medicamento acidentalmente, deve procurar um médico ou um centro de intoxicação imediatamente. O apoio médico imediato é fundamental para adultos e crianças, mesmo se os sinais e sintomas de intoxicação não estiverem presentes.
Bosentana foi administrada em dose única de até 2.400 mg em pacientes saudáveis e até 2.000 mg por dia durante 2 meses em pacientes afetados por outras doenças diferentes da hipertensão arterial pulmonar. A reação adversa mais comum foi cefaleia ( dor de cabeça) de intensidade leve a moderada.
A superdose maciça pode resultar em hipotensão pronunciada, exigindo um suporte cardiovascular ativo.
Nota: bosentana não é removida através da diálise.
Em caso de utilização de grandes quantidades deste medicamento, procure ajuda médica rapidamente e leve a embalagem ou a bula do medicamento, se possível.
Todo medicamento deve ser mantido fora do alcance das crianças.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder.
Interação medicamentosa: quais os efeitos de tomar Bosentana Zodiac com outros remédios?
Bosentana não deve ser administrada concomitantemente à ciclosporina A. Uma vez que os contraceptivos hormonais não são eficazes como o único método contraceptivo quando se administra bosentana, seu médico e/ou ginecologista estabelecerá um método contraceptivo apropriado para você. Consulte seu médico a respeito das interações medicamentosas com ciclosporina A, gliblencamida, varfarina , sinvastatina , cetoconazol , fluconazol, itraconazol , ritonavir , voriconazol , contraceptivos hormonais, tacrolimus, sirolimus, rifampicina, epoprostenol, sildenafila, digoxina , nimodipina, losartana, lopinavir+ritonavir e medicamentos para o tratamento de infecção por HIV.
A ingestão concomitante de alimentos não interfere na absorção do medicamento.
Testes durante o tratamento
Testes que seu médico poderá solicitar durante o tratamento
Alguns pacientes tratados com bosentana mostraram alterações nos testes de função hepática e anemia (baixo nível de hemoglobina). Durante o tratamento com bosentana, seu médico agendará exames de sangue regulares para verificar mudanças em função hepática e no nível de hemoglobina.
Exames de sangue para avaliação de função hepática
Estes exames serão realizados antes do início do tratamento com bosentana e então, mensalmente, durante o tratamento com bosentana. Após cada aumento de dose, um exame de sangue adicional deverá ser realizado após 2 semanas.
Exame de sangue para avaliação de anemia
Estes exames serão realizados antes do início do tratamento com bosentana, e então, mensalmente, durante os 4 primeiros meses de tratamento com bosentana, passando, então a serem trimestrais.
Caso os resultados estejam alterados, seu médico poderá reduzir a dose ou interromper o tratamento com bosentana e, realizar exames adicionais para encontrar a causa.
Para sua própria segurança, é muito importante que você realize exames de sangue para função hepática e anemia regularmente.
Exames de gravidez para mulheres em idade fértil
Devido ao risco de falha no método contraceptivo hormonal durante o tratamento com bosentana e o risco de haver uma piora grave e rápida da doença nos pacientes com hipertensão arterial pulmonar, exames de gravidez mensais são recomendados antes e durante o tratamento com bosentana.
Qual a ação da substância do Bosentana Zodiac (Bosentana)?
Resultados da eficácia
Modelos animais
Em modelos animais com hipertensão pulmonar, a administração oral crônica de bosentana reduziu a resistência vascular pulmonar e inverteu a hipertrofia vascular dos pulmões e do ventrículo direito. Em um modelo em animais com fibrose pulmonar, bosentana reduziu a deposição de colágeno nos pulmões.
Adultos com hipertensão arterial pulmonar
Dois estudos clínicos randomizados, duplo-cego, multicêntricos, controlados por placebo foram realizados em 32 (AC-052-351) e 213 (estudo AC-052-352 [BREATHE-1]) pacientes adultos com HAP (hipertensão pulmonar primária (idiopática ou hereditária) ou hipertensão pulmonar secundária à esclerodermia ) com classe funcional III e IV da OMS. Após 4 semanas de bosentana 62,5 mg, duas vezes ao dia, as doses de manutenção avaliadas nestes estudos foram de 125 mg, duas vezes ao dia, no AC-052- 351 e 125 mg, duas vezes ao dia, e 250 mg, duas vezes ao dia, no AC-052-352.
Bosentana foi adicionada à terapia atual dos pacientes, que poderia incluir uma combinação de anticoagulantes, vasodilatadores (por exemplo, bloqueadores do canal de cálcio), diuréticos , oxigênio e digoxina , mas não epoprostenol. O controle foi placebo mais a terapia atual.
O desfecho primário foi a mudança na distância percorrida em 6 minutos em 12 semanas para o primeiro estudo e 16 semanas para o segundo estudo. Em ambos os estudos, o tratamento com bosentana resultou em aumentos significativos na capacidade de se exercitar.
Os aumentos corrigidos pelo placebo na distância percorrida em comparação ao período basal foram de 76 metros (p = 0,02, teste t) e 44 metros (p= 0,0002, teste U de Mann-Whitney ) no desfecho primário de cada estudo, respectivamente.
As diferenças entre os dois grupos de dose, 125 mg, duas vezes ao dia, e 250 mg, duas vezes ao dia, não foram estatisticamente significativas, mas houve uma tendência de melhora da capacidade de se exercitar em pacientes tratados com 250 mg, duas vezes ao dia.
A melhora na distância percorrida foi aparente após 4 semanas de tratamento, e ficou claramente evidente após 8 semanas de tratamento e foi mantida por até 28 semanas de tratamento duplo-cego em um subconjunto da população de pacientes.
Efeitos de bosentana na distância percorrida de 6 minutos
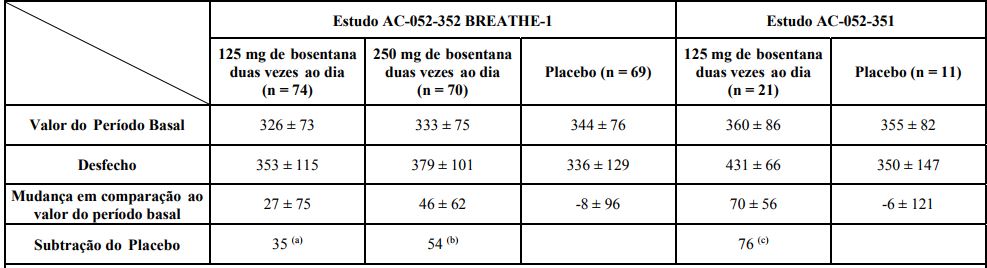
Distância em metros: média ± desvio padrão.
Mudanças são até a Semana 16 para BREATHE-1 e até a Semana 12 para o Estudo AC-052-351.
(a) p = 0,01; por Wilcoxon.
(b) p = 0,0001; por Wilcoxon.
(c) p = 0,02; por teste t de Student .
Em uma análise retrospectiva dos respondedores com base na alteração da distância percorrida, da classe funcional da OMS e da dispneia de 95 pacientes randomizados para 125 mg de bosentana, duas vezes ao dia, em estudos controlados por placebo, verificou-se que na Semana 8, 66 pacientes tinham melhorado, 22 mantiveram-se estáveis e 7 tinham piorado. Dos 22 pacientes estáveis na Semana 8, 6 melhoraram na Semana 12/16 e 4 pioraram em comparação ao período basal. Dos 7 pacientes que pioraram, na Semana 8, 3 melhoraram na Semana 12/16 e 4 pioraram em comparação com um período basal.
Os parâmetros hemodinâmicos invasivos foram avaliados apenas no estudo AC-052-351. O tratamento com bosentana levou a um aumento significativo do índice cardíaco (CI), associado com uma redução significativa na pressão arterial pulmonar (PAP), na resistência vascular pulmonar (RVP) e na pressão atrial direita média.
Alteração a partir do Período Basal até a Semana 12: parâmetros hemodinâmicos
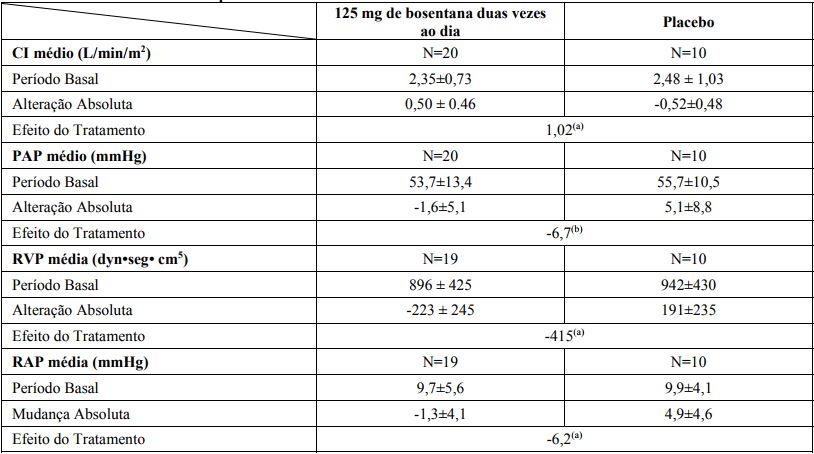
Os valores mostrados são médias ± DP.
(a) p≤0,001.
(b) p <0,02 CI = índice cardíaco.
PAP = pressão arterial pulmonar.
PVR = resistência vascular pulmonar.
RAP = pressão atrial direita.
Uma redução nos sintomas da HAP foi observada no tratamento com bosentana. A medição da dispneia durante os testes de caminhada mostrou uma melhora em pacientes tratados com bosentana. No Estudo BREATHE-1, 92% dos 213 pacientes foram classificados no período basal como classe funcional III e 8% na classe IV da OMS. O tratamento com bosentana levou a uma melhora na classe funcional da OMS em 42,4% dos pacientes (placebo 30,4%).
A mudança geral da classe funcional da OMS para ambos os estudos foi significativamente melhor em pacientes tratados com bosentana em comparação com pacientes tratados com placebo. O tratamento com bosentana foi associado com uma redução significativa na taxa de agravamento clínico em comparação com o placebo em 28 semanas (10,7% versus 37,1%, respectivamente p = 0,0015).
Incidência de piora clínica, População com Intenção de Tratar
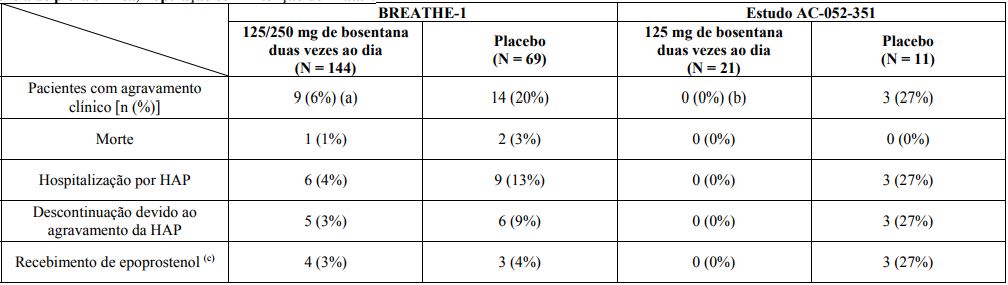
Observação: Os pacientes podem ter tido mais do que uma razão para agravamento clínico.
(a p = 0,0015 versus placebo pelo teste de log-rank . Não houve diferença relevante entre os grupos tratados com 125 mg e 250 mg, duas vezes ao dia.
(b) p = 0,033 versus placebo pelo teste exato de Fisher .
(c) Recebimento de epoprostenol sempre foi uma consequência do agravamento clínico.
Em um estudo clínico randomizado, duplo-cego, multicêntrico, controlado por placebo (AC-052-364 [EARLY]), 185 pacientes com HAP com classe funcional II da OMS (distância média caminhada em seis minutos no período basal de 435 metros) receberam 62,5 mg de bosentana, duas vezes ao dia, durante 4 semanas, seguido de 125 mg, duas vezes ao dia, (n = 93) ou placebo (n = 92) durante 6 meses.
Os pacientes incluídos eram virgens de tratamento para HAP (n = 156) ou estavam em dose estável de sildenafila (n = 29). Os desfechos coprimários foram a variação percentual a partir do período basal na RVP e alteração da distância percorrida no teste de caminhada de 6 minutos a partir do período basal para o Mês 6 versus placebo. A tabela abaixo ilustra a análise principal.
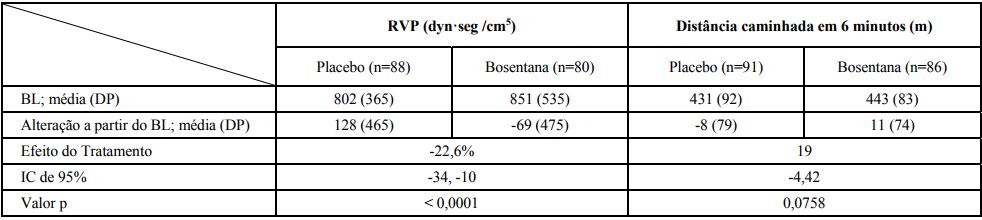
Foi avaliado como desfecho secundário o tempo para o agravamento clínico (avaliado como a soma de morte, hospitalização devido a complicações da HAP ou progressão sintomática da HAP).
Houve um atraso significativo no tempo para agravamento clínico (observado primeiramente como progressão sintomática da HAP) com bosentana comparado com placebo (taxa de risco de 0,2; p = 0,01). Os achados foram consistentes nos estratos com ou sem o tratamento com sildenafila no período basal.
Estudo em pacientes do sexo masculino com hipertensão arterial pulmonar (HAP) para avaliar a espermatogênese
O estudo AC-052-402 avaliou o efeito sobre a função testicular de 62,5 mg de bosentana, duas vezes ao dia, durante 4 semanas, seguida de 125 mg de bosentana duas vezes ao dia por 5 meses.
Foram incluídos 25 pacientes do sexo masculino com HAP de classe funcional III e IV da OMS e com contagem espermática normal no período basal; 23 concluíram o estudo e dois descontinuaram devido a eventos adversos não relacionados com a função testicular. A contagem de esperma permaneceu dentro da faixa normal em todos os 22 pacientes com dados coletados após 6 meses de tratamento e não foram observadas alterações na morfologia espermática, na motilidade espermática ou nos níveis hormonais.
Um paciente desenvolveu oligospermia acentuada em 3 meses e a contagem de esperma permaneceu baixa em duas medições de acompanhamentos realizadas depois de 6 semanas subsequentes. Bosentana foi interrompida e depois de 2 meses a contagem de esperma havia retornado aos níveis do período basal. A relevância desta observação é incerta, considerando-se a grande variabilidade natural das quantidades de esperma entre os indivíduos.
Apesar disso, e com base neste achado, não se pode excluir a possibilidade de que os antagonistas dos receptores da endotelina, como a bosentana, possam ter um efeito sobre a espermatogênese. A ausência de um efeito sistemático crônico no tratamento com bosentana na função testicular em humanos observados neste estudo é consistente com os dados de toxicidade da bosentana.
Estudos de longo prazo
Não existem estudos que demonstrem os efeitos benéficos do tratamento com bosentana na sobrevida. Entretanto, o estado vital de longo prazo foi registrado para todos os 235 pacientes que foram tratados com bosentana nos dois estudos pivotais controlados por placebo (AC-052-351 e AC-052-352) e/ou em suas duas extensões abertas, não controladas.
O tempo médio de exposição à bosentana foi de 1,9 anos ± 0,7 anos (mínimo: 0,1 anos: máx: 3,3 anos) e os pacientes foram observados por um período médio de 2,0 ± 0,6 anos.
A maioria dos pacientes foi diagnosticada com hipertensão pulmonar primária (72%) e estava na classe funcional III da OMS (84%). Nesta população total, as estimativas de sobrevida de Kaplan- Meier foram de 93% e 84%, 1 a 2 anos após o início do tratamento com bosentana, respectivamente.
As estimativas de sobrevida foram mais baixas no subgrupo de pacientes com HAP secundária à esclerose sistêmica. As estimativas podem ter sido influenciadas pelo início do tratamento com epoprostenol em 43/235 pacientes.
Os dados de longo prazo sobre HAP de classe funcional II da OMS foram gerados a partir de todos os 173 pacientes que foram tratados com bosentana no estudo controlado AC- 052-364 (EARLY) e/ou a sua extensão aberta (OL). A duração média de exposição ao tratamento com bosentana foi de 3,6 ± 1,8 anos (até 6,1 anos), com 73% dos pacientes tratados por pelo menos 3 anos e 62% por pelo menos quatro anos.
Os pacientes poderiam receber tratamento adicional para HAP como solicitado na extensão aberta (OL). A maioria dos pacientes foi diagnosticada com hipertensão arterial pulmonar idiopática ou hereditária (61%). A capacidade de se exercitar (distância percorrida em 6 minutos) foi mantida durante todo o tratamento com bosentana (mudança média a partir do período basal até o final do tratamento - 3,7 m).
No geral, 78% dos pacientes permaneceram na classe funcional II ou em uma classe melhor da OMS. As estimativas de Kaplan-Meier para sobrevida foram de 90% e 85% em 3 e 4 anos após o início do tratamento, respectivamente. Nos mesmos pontos de tempo, 88% e 79% dos pacientes permaneceram livres de agravamento da HAP (definida como morte por todas as causas, transplante pulmonar, septostomia atrial ou início do tratamento com prostanoide intravenoso ou subcutâneo).
No estudo de extensão OL (AC -052- 409) do AC -052- 405 (BREATHE -5) em pacientes com HAP de classe funcional III da OMS e síndrome de Eisenmenger associado à doença cardíaca congênita, 26 pacientes continuaram a receber bosentana durante um período de tratamento de 24 semanas (média de 24,4 ± 2,0 semanas). Os efeitos da bosentana demonstrados no período duplo-cego do tratamento foram, de modo geral, mantidos durante o tratamento mais prolongado (um período total de tratamento de 40 semanas).
Hipertensão Arterial Pulmonar associada à doença cardíaca congênita
Em um estudo clínico prospectivo, multicêntrico, randomizado, duplo-cego, controlado por placebo (AC- 052-405 [BREATHE-5]), os pacientes com HAP de classe funcional III da OMS e com síndrome de Eisenmenger associada com doença cardíaca congênita receberam 62,5 mg de bosentana, duas vezes ao dia, por 4 semanas, e depois 125 mg de bosentana, duas vezes ao dia, por mais 12 semanas (n = 37) ou placebo (n = 17).
O objetivo primário mostrou que bosentana não piorou a hipoxemia. Após 16 semanas, a saturação média de oxigênio aumentou no grupo de bosentana em 1,0% (intervalo de confiança de 95% - 0,7%; 2,8%), quando comparado com grupo com placebo, demonstrando que bosentana não piorou a hipoxemia. No grupo com bosentana a resistência vascular pulmonar média reduziu significativamente (com um efeito predominante no subgrupo de pacientes com shunt intracardíaco bidirecional). Após 16 semanas, o aumento médio, corrigido para o placebo, da distância percorrida no teste de caminhada de 6 minutos foi de 53 metros (p = 0,0079), refletindo melhora na capacidade de se exercitar.
Hipertensão Arterial Pulmonar associada ao HIV
Um estudo clínico aberto, não controlado (AC-052-362) foi realizado em 16 pacientes com HAP de classe funcional III da OMS associado com a infecção pelo HIV. Os pacientes foram tratados com 62,5 mg de bosentana, duas vezes ao dia, durante 4 semanas, seguido de 125 mg de bosentana, duas vezes ao dia, por 12 semanas adicionais.
Após 16 semanas de tratamento, houve melhora significativa na capacidade física a partir do período basal: o aumento médio na distância percorrida em 6 minutos foi de 91,4 metros de 332,6 metros, em média, no período basal (p < 0,001). Nenhuma conclusão formal pode ser tirada em relação aos efeitos da bosentana sobre a eficácia dos medicamentos antirretrovirais.
Estudo em crianças com Hipertensão Arterial Pulmonar
Bosentana foi avaliada em um estudo aberto, não controlado em 19 pacientes pediátricos com HAP: 3 a 15 anos de idade. Os pacientes apresentavam hipertensão pulmonar primária (10 pacientes) ou HAP relacionada a doenças cardíacas congênitas (9 pacientes) e apresentavam classe funcional II da OMS (n = 15 pacientes, 79%) ou classe III (n = 4, 21%) no período basal. Os pacientes foram divididos em três grupos de acordo com o peso corporal, e receberam doses de bosentana de aproximadamente 2 mg/kg, duas vezes ao dia durante 12 semanas. Metade dos pacientes em cada grupo já tinha sido tratado com epoprostenol intravenoso e a dose de epoprostenol permaneceu constante durante todo o estudo.
A hemodinâmica foi avaliada em 17 pacientes. O aumento médio do índice cardíaco a partir do período basal foi de 0,5 L/min/m 2 , a diminuição média na pressão arterial pulmonar foi de 8 mmHg e a redução da média na resistência vascular pulmonar foi de 389 dyn·seg·cm-5.
Estas melhoras hemodinâmicas a partir do período basal foram semelhantes, com ou sem administração concomitante de epoprostenol. Mudanças nos parâmetros do teste de exercício na Semana 12 em comparação com o período basal foram altamente variáveis e nenhuma foi significativa.
Uso Concomitante com epoprostenol
O uso combinado de bosentana e epoprostenol foi investigado em dois estudos clínicos BREATHE-2 e BREATHE-3. BREATHE-2 foi um estudo clínico multicêntrico, randomizado, duplo-cego, de grupos paralelos de bosentana versus placebo em 33 pacientes com hipertensão arterial pulmonar grave que estavam recebendo terapia concomitante com epoprostenol. BREATHE-3 foi um estudo clínico aberto, não controlado com 10 dos 19 pacientes pediátricos recebendo bosentana e epoprostenol concomitantemente durante um estudo de 12 semanas.
O perfil de segurança da terapia combinada não foi diferente do que o esperado com cada componente e a terapia combinada foi bem tolerada em crianças e adultos. O benefício clínico de terapia combinada não foi mostrado.
Esclerose sistêmica com úlceras digitais
Dois estudos clínicos multicêntricos, duplo-cegos, randomizados, controlados por placebo foram realizados em 122 (estudo -RAPIDS -1) e 190 pacientes adultos (estudo RAPIDS -2) com esclerose sistêmica e úlceras digitais (ou úlceras digitais em curso ou histórico de úlceras digitais no ano anterior). No estudo AC-052-331 (RAPIDS -2) os pacientes tinham de ter, pelo menos, uma úlcera digital de início recente, e entre os dois estudos, 85% dos pacientes tinham úlceras digitais em curso no período basal.
Após 4 semanas de 62,5 mg de bosentana, duas vezes ao dia, as doses de manutenção estudadas em ambos os estudos foram de 125 mg, duas vezes ao dia. A duração do tratamento duplo-cego foi de 16 semanas no estudo RAPIDS-1 e 24 semanas no estudoRAPIDS-2. Tratamentos de fundo para a esclerose sistêmica e úlceras digitais eram permitidos, case se mantivessem constantes por, pelo menos, um mês após o início do tratamento e durante o período duplo-cego do estudo.
O número de novas úlceras digitais a partir do período basal até o desfecho do estudo foi o desfecho primário em ambos os estudos. O tratamento com bosentana resultou em números mais baixos de novas úlceras digitais durante o tratamento quando comparado ao placebo. No estudoRAPIDS-1, durante 16 semanas de tratamento duplo-cego, os pacientes no grupo bosentana desenvolveram uma média de 1,4 nova úlcera digital versus 2,7 novas úlceras digitais no grupo placebo (p = 0,0042).
No estudo RAPIDS-2, durante 24 semanas de tratamento duplo-cego, os números correspondentes foram, respectivamente, 1,9 versus 2,7 novas úlceras digitais (p = 0,0351). Em ambos os estudos, a probabilidade de desenvolver novas úlceras digitais foi menor nos pacientes recebendo bosentana durante o estudo, além de ter sido demonstrado que estes pacientes levavam mais tempo para desenvolver uma nova úlcera digital sucessiva em comparação àqueles no grupo placebo.
O efeito da bosentana sobre a redução do número de novas úlceras digitais foi mais pronunciado em pacientes com úlceras digitais múltiplas.
Nenhum efeito da bosentana foi notado no tempo de cicatrização de úlceras digitais em qualquer um dos estudos.
Dados de segurança pré-clínica
Um estudo de carcinogenicidade de 2 anos em camundongos demonstrou um aumento na incidência combinada de adenomas e carcinomas hepatocelulares em camundongos machos, mas não em camundongos fêmeas, a concentrações plasmáticas de cerca de 2-4 vezes àquela alcançada em dose terapêutica em seres humanos.
Em ratos, a administração oral de bosentana durante 2 anos produziu um pequeno, mas significante, aumento na incidência combinada de adenomas de células foliculares de tireoide e de carcinoma nos machos, mas não nas fêmeas, em concentrações plasmáticas de cerca de 9 a 14 vezes àquelas encontradas em seres humanos recebendo doses terapêuticas.
Bosentana foi negativa em testes de genotoxicidade. Houve evidência de um leve desequilíbrio hormonal tireoidiano induzido pela bosentana em ratos. No entanto, não houve evidência de que bosentana pudesse afetar a função da tireoide (tiroxina, TSH ) em seres humanos.
O efeito da bosentana sobre a função mitocondrial é desconhecida.
Bosentana demonstrou ser teratogênica em ratos com exposições plasmáticas superiores a 1,5 vezes daquelas alcançadas em doses terapêuticas em seres humanos. Efeitos teratogênicos, incluindo malformações de cabeça e rosto e dos vasos importantes, foram dose dependentes.
As similaridades do padrão de malformações observadas com outros antagonistas dos receptores da endotelina (ET) e na ET de camundongos knock-out indicam um efeito de classe.
Precauções apropriadas devem ser tomadas por mulheres em idade fértil.
Nos estudos de fertilidade em ratos machos e fêmeas a concentrações plasmáticas de 21 e 43 vezes, respectivamente, considerado o nível terapêutico esperado em seres humanos, não foram observados efeitos na contagem, motilidade e viabilidade dos espermatozoides, nem no desempenho do acasalamento ou fertilidade.
Também não houve nenhum efeito adverso sobre o desenvolvimento do embrião, antes da implantação ou no momento da implantação.
Uma incidência levemente aumentada da atrofia tubular testicular foi observada em ratos que receberam bosentana oralmente a doses tão baixas quanto 125 mg/kg (cerca de 4 vezes a dose máxima recomendada para seres humanos [MRHD] e a dose mais baixa testada) por dois anos, mas não em doses tão altas quanto 1500 mg/kg/dia (cerca de 50 vezes a MRHD) por seis meses.
Em um estudo de toxicidade em ratos jovens, no qual ratos foram tratados a partir do Dia 4 pós-parto até a vida adulta, foram observados após o desmame redução nos pesos absolutos testiculares e do epidídimo e redução no número de espermatozoides no epidídimo. O NOAEL foi 21 vezes (no Dia 21 pós-parto) e 2,3 vezes (Dia 69 pós-parto) a exposição terapêutica humana, respectivamente.
Não foram detectados efeitos no desenvolvimento geral, crescimento, função sensorial e cognitiva e desempenho reprodutivo a uma exposição terapêutica de 7 vezes em crianças com HAP.
Características farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
Bosentana é um antagonista dos receptores da endotelina com afinidade aos receptores da endotelina A e B (ETA e ETB). Bosentana reduz a resistência vascular pulmonar e sistêmica, resultando em aumento do rendimento cardíaco sem aumentar o ritmo cardíaco.
O neuro-hormônio endotelina-1 (ET-1) é um dos mais potentes vasoconstritores conhecidos e pode também promover a fibrose, a proliferação celular, hipertrofia cardíaca e a remodelação e é pró-inflamatório. Estes efeitos são mediados pela ligação da ET-1 a aos receptores ETA e ETB localizados nas células do endotélio e do músculo liso vascular.
As concentrações de ET-1 nos tecidos e plasma são aumentadas em várias doenças do tecido conjuntivo e cardiovasculares, incluindo HAP, esclerodermia, insuficiência cardíaca aguda e crônica, isquemia do miocárdio, hipertensão sistêmica e arteriosclerose, o que sugere que ET-1 desempenha um papel patogênico nestas doenças.
Na HAP e insuficiência cardíaca, na ausência de antagonista de receptor de endotelina, concentrações elevadas de ET-1 estão fortemente correlacionadas com a gravidade e o prognóstico destas doenças.
Bosentana compete com a ligação da ET-1 e outros peptídeos ET aos receptores ETA e ETB, com uma afinidade ligeiramente mais alta aos receptores ETA (Ki = 4,1-43 nM) em comparação aos receptores ETB (Ki = 38-730 nM). Bosentana antagoniza especificamente com os receptores de ET e não se liga a outros receptores.
Propriedades farmacocinéticas
A farmacocinética da bosentana foi documentada principalmente em indivíduos saudáveis.
Dados limitados em pacientes mostram que a exposição à bosentana em pacientes adultos com hipertensão arterial pulmonar é cerca de duas vezes maior em comparação aos indivíduos adultos saudáveis.
Em adultos saudáveis, bosentana apresenta propriedades farmacocinéticas dependentes de dose e tempo.
O clearance e o volume de distribuição diminuem com doses intravenosas elevadas e aumentam com o tempo. Após a administração oral do medicamento, a exposição sistêmica é proporcional à dose até 500 mg. Com doses orais mais elevadas, a concentração plasmática máxima (C máx ) e a área sob a curva (AUC) aumentam menos do que proporcionalmente à dose.
Absorção
Em voluntários saudáveis, a biodisponibilidade absoluta de bosentana é cerca de 50% e não é afetada pelos alimentos. As concentrações plasmáticas máximas são alcançadas dentro de 3 a 5 horas após a administração.
Distribuição
Bosentana é altamente ligante (> 98%) às proteínas plasmáticas, principalmente a albumina. Bosentana não penetra nos eritrócitos.
Após uma dose intravenosa de 250 mg de bosentana, o volume de distribuição (Vd) foi determinado em cerca de 18 litros.
Biotransformação e Eliminação
Após uma administração intravenosa de uma dose única de 250 mg, o clearance foi de 8,2 L/h. A meia-vida de eliminação terminal (t1/2) foi de 5,4 horas.
Após a administração de doses múltiplas, as concentrações plasmáticas de bosentana diminuíram gradualmente de 50%-65% daquelas observadas após a administração de uma dose única.
Esta diminuição é provavelmente devido à autoindução de enzimas metabolizadas no fígado . O estado de equilíbrio é atingido em 3-5 dias.
Bosentana é eliminada por excreção biliar após ser metabolizada no fígado pelas isoenzimas CYP, CYP2C9 e CYP3A4. É recuperada na urina menos de 3% das doses administradas por via oral.
A bosentana gera três metabólitos e apenas um deles é farmacologicamente ativo. Este metabólito é excretado principalmente inalterado pela bile. Em pacientes adultos, a exposição ao metabólito ativo é maior em comparação aos indivíduos saudáveis. A exposição ao metabólito ativo pode aumentar em pacientes com evidência de colestase.
Bosentana é um indutor da CYP2C9, CYP3A4, possivelmente, também da CYP2C19 e glicoproteína-P.
In vitro , a bosentana inibe as bombas eliminadoras de sais biliares em culturas de hepatócitos.
Os dados in vitro demostraram que bosentana não tem efeito inibitório relevante sobre isoenzimas CYP testadas (CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 2E1, 3A4).
Consequentemente, bosentana não deverá aumentar as concentrações plasmáticas de produtos medicamentosos metabolizados por estas isoenzimas.
Farmacocinética em populações especiais
Crianças
A farmacocinética de doses orais únicas e múltiplas foi estudada em pacientes pediátricos com hipertensão arterial pulmonar com uma dose baseada no peso corporal. A exposição à bosentana diminuiu ao longo do tempo de maneira consistente com as propriedades conhecidas de autoindução da bosentana.
Os valores médios da AUC (CV%) de bosentana em pacientes pediátricos tratados com 31,25; 62,50 ou 125 mg, duas vezes ao dia, foram 3.496 (49); 5.428 (79) e 6.124 (27) ng·h/mL, respectivamente, e foram mais baixos aos valores observados em pacientes adultos com HAP recebendo 125 mg duas vezes ao dia: 8.149 (47) ng·h/mL.
A exposição sistêmica em pacientes pediátricos com pesos de 10-20 kg, 20-40 kg e mais de 40 kg foi em estado de equilíbrio: 43%, 67% e 75% da exposição sistêmica em adultos, respectivamente.
As consequências destes achados em relação à hepatotoxicidade são desconhecidas. O gênero e/ou uso concomitante de epoprostenol intravenoso não tiveram efeito significativo sobre a farmacocinética de bosentana.
Insuficiência hepática
Não foram observadas alterações relevantes na farmacocinética em pacientes com função hepática levemente comprometida (Child-Pugh classe A).
A AUC de bosentana no estado de equilíbrio foi 9% mais alta e a AUC do metabólito ativo, Ro 48-5033, foi 33% mais alta em pacientes com comprometimento hepático leve em comparação com indivíduos saudáveis. Em pacientes com função hepática moderadamente comprometida ( Child-Pugh B) e hipertensão arterial pulmonar associada à hipertensão portal, a AUC de bosentana em estado de equilíbrio foi 4,7 vezes mais alta e a AUC do metabólito ativo, Ro 48-5033, foi 12,4 vezes mais alta em comparação aos pacientes com hipertensão arterial pulmonar e função hepática normal. A farmacocinética da bosentana não foi estudada em pacientes com comprometimento hepático de Child-Pugh classe C. Bosentana deve, de modo geral, ser evitada em pacientes com comprometimento de moderado a grave, ou seja, Child-Pugh Classe B ou C.
Insuficiência renal
Em pacientes com insuficiência renal grave ( clearance de creatinina 15-30 mL/min), as concentrações plasmáticas de bosentana diminuíram em aproximadamente 10%. As concentrações plasmáticas dos metabólitos de bosentana aumentaram cerca de 2 vezes nestes pacientes em comparação aos indivíduos com função renal normal. Nenhum ajuste de dose é necessário em pacientes com comprometimento renal. Não há experiência clínica específica em pacientes sendo submetidos à diálise.
Com base nas propriedades físico-químicas e do alto nível de ligação proteica, não se espera que a bosentana seja removida da circulação de forma significativa por meio de diálise. Este medicamento é contraindicado para crianças menores de 03 anos.
Como devo armazenar o Bosentana Zodiac?
Este medicamento deve ser mantido em temperatura ambiente (entre 15 e 30ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do medicamento
Bosentana é um comprimido revestido oblongo, biconvexo, com ranhura unilateral e de cor rosa claro.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o médico ou o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Bosentana Zodiac
Reg. MS - 1.2214.0086
Resp. Téc.:
Marcia da Costa Pereira
CRF-SP n° 32.700
Fabricado por:
Monte Verde S.A.
Ruta Nacional nº 40
San Juan - Argentina
Importado por:
Zodiac Produtos Farmacêuticos S/A.
Rodovia Vereador Abel Fabrício Dias, 3400
Pindamonhangaba - SP
C.N.P.J. 55.980.684/0001-27
Indústria Brasileira
SAC: 0800-166575
Venda sob prescrição médica.